题目内容
Na2S溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Na2S2,其溶液显黄色.
(1)该反应中的Na2S表现了______性,当生成1mol Na2S2时,转移电子数目为______.
(2)完成该反应的化学方程式:______.
(3)Na2S2的溶液与稀硫酸反应产生的现象为______.
(4)在碱性溶液中,多硫化钠Na2Sx(x≥2),可被NaClO氧化为硫酸钠,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则x的值为______.
A.5 B.4 C.3 D.2.
解:(1)Na2S溶液在空气中长期放置,与氧气反应,被氧化,体现其还原性;S元素的化合价由-2价变为-1价,则当生成1mol Na2S2时,转移的电子数为1mol×2×(2-1)×NA=2NA个,故答案为:还原;2NA;
(2)Na2S、氧气、水反应生成Na2S2、NaOH,该反应的方程式为4Na2S+O2+2H2O═4NaOH+2Na2S2,故答案为:4Na2S+O2+2H2O═4NaOH+2Na2S2;
(3)Na2S2的溶液与稀硫酸反应生成硫酸钠、S、硫化氢,则观察到现象为溶液由黄色变为无色,产生浅黄色沉淀和臭鸡蛋气味的气体,
故答案为:溶液由黄色变为无色,产生浅黄色沉淀和臭鸡蛋气味的气体;
(4)多硫化钠Na2Sx被NaClO氧化为硫酸钠,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的物质的量之比为1:16,
由电子守恒可知1mol×[6-(-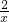 )]×x=16mol×[1-(-1)],解得x=5,故答案为:A.
)]×x=16mol×[1-(-1)],解得x=5,故答案为:A.
分析:(1)Na2S溶液在空气中长期放置,与氧气反应,被氧化;由元素的化合价变化计算转移的电子数;
(2)Na2S、氧气、水反应生成Na2S2、NaOH,以此书写方程式;
(3)反应生成硫酸钠、S、硫化氢,以此分析现象;
(4)反应中Na2Sx与NaClO的物质的量之比为1:16,利用电子守恒计算x.
点评:本题考查氧化还原反应,明确发生的氧化还原反应及习题中的信息是解答本题的关键,注意元素的化合价变化及电子守恒的应用,题目难度中等.
(2)Na2S、氧气、水反应生成Na2S2、NaOH,该反应的方程式为4Na2S+O2+2H2O═4NaOH+2Na2S2,故答案为:4Na2S+O2+2H2O═4NaOH+2Na2S2;
(3)Na2S2的溶液与稀硫酸反应生成硫酸钠、S、硫化氢,则观察到现象为溶液由黄色变为无色,产生浅黄色沉淀和臭鸡蛋气味的气体,
故答案为:溶液由黄色变为无色,产生浅黄色沉淀和臭鸡蛋气味的气体;
(4)多硫化钠Na2Sx被NaClO氧化为硫酸钠,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的物质的量之比为1:16,
由电子守恒可知1mol×[6-(-
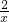 )]×x=16mol×[1-(-1)],解得x=5,故答案为:A.
)]×x=16mol×[1-(-1)],解得x=5,故答案为:A.分析:(1)Na2S溶液在空气中长期放置,与氧气反应,被氧化;由元素的化合价变化计算转移的电子数;
(2)Na2S、氧气、水反应生成Na2S2、NaOH,以此书写方程式;
(3)反应生成硫酸钠、S、硫化氢,以此分析现象;
(4)反应中Na2Sx与NaClO的物质的量之比为1:16,利用电子守恒计算x.
点评:本题考查氧化还原反应,明确发生的氧化还原反应及习题中的信息是解答本题的关键,注意元素的化合价变化及电子守恒的应用,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目