��Ŀ����
���״�����Ҫ�Ļ�ѧ��ҵ����ԭ�Ϻ����Һ��ȼ�ϣ����㷺�����л��ϳɡ�ҽҩ��ũҩ��Ϳ�ϡ�Ⱦ�ϡ����������ȹ�ҵ�С���ҵ��һ���ں����ܱ������в������з�Ӧ�ϳɼ״���
CO(g) 2H2(g)
2H2(g) CH3OH(g)
CH3OH(g) Q
Q
�±����������Ƿ�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
��1���жϷ�Ӧ�ﵽƽ��״̬�������ǣ� ��
A�����������ܶȲ���
B����������ƽ����Է�����������
C������CH3OH������������CO���������
D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
��2���ɱ��������ж�Q 0 �����������
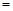 ����������Ҫ���COת���ʣ��ɲ�ȡ�Ĵ�ʩ
����������Ҫ���COת���ʣ��ɲ�ȡ�Ĵ�ʩ�ǣ� ��
A��������� B������CO C������H2 D������
��3��ij�¶��£���2 mol CO��6 mol H2����2 L���ܱ������У���ַ�Ӧ10min�ﵽƽ��ʱ���c
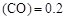 mol��L������CH3OH��ʾ�ķ�Ӧ����v
mol��L������CH3OH��ʾ�ķ�Ӧ����v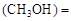 mol /(L��min)��
mol /(L��min)��CO��ת����Ϊ ��
��4��ԭ��CO��H2������C��H2O��Ӧ��ȡ���漰�ķ�Ӧ����ʽ���£�
C(s)
 CO2(g)
CO2(g)  2CO(g) ƽ�ⳣ��K1
2CO(g) ƽ�ⳣ��K1C(s)
 H2O(g)
H2O(g)  CO(g)
CO(g) H2(g) ƽ�ⳣ��K2
H2(g) ƽ�ⳣ��K2CO(g)
 H2O(g)
H2O(g)  H2(g)
H2(g) CO2(g) ƽ�ⳣ��K3
CO2(g) ƽ�ⳣ��K3��K1��K2��K3֮��Ĺ�ϵ�ǣ� ��
��1��BD (2��)
��2��>(1��)��C (1��)
��3��0.08 (1��) 80% (1��)
��4��K2=K1��K3 (2��)
�������������
��1��A�����ܱ�������������䣬�������壬�����غ㣬���������ܶ�ʼ�ղ��䣬������ƽ���־������B��ȷ��C����CH3OH������CO��������ͬ�����ʣ�����D��ȷ��
��2���ɱ���֪��T���ߣ�K��С������Ӧ�Ƿ��ȷ�Ӧ��Q>0�����COת���ʣ���Ӧ������У�ѡC��
��3�� CO(g) 2H2(g)
2H2(g)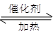 CH3OH(g)
CH3OH(g) Q
Q
��Ũ�ȣ� 1 3 0
��Ũ�� 0.8 1.6 0.8
ƽ�� 0.2
v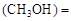 0.8/10=0.08(mol��L��min)
0.8/10=0.08(mol��L��min)
CO��ת����=" 0.8" /1*100%= 80%
��4����C(s) CO2(g)
CO2(g)  2CO(g) ƽ�ⳣ��K1
2CO(g) ƽ�ⳣ��K1
��C(s) H2O(g)
H2O(g)  CO(g)
CO(g) H2(g) ƽ�ⳣ��K2
H2(g) ƽ�ⳣ��K2
��CO(g) H2O(g)
H2O(g)  H2(g)
H2(g) CO2(g) ƽ�ⳣ��K3
CO2(g) ƽ�ⳣ��K3
��=��+�� ����K2=K1��K3
���㣺�����Ի�������Ϊ����������ƽ�ⳣ����ƽ������֪ʶ��

I.��¯��������Ҫ��ӦΪFe2O3��3CO2Fe��3CO2��
��֪�÷�Ӧ��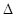 H����1000��ʱ��K=64����1000����������ݻ�10 L���ܱ������У�����Fe��Fe2O3��CO��CO2��1��OmoI����Ӧ��10 min��ﵽƽ�⡣
H����1000��ʱ��K=64����1000����������ݻ�10 L���ܱ������У�����Fe��Fe2O3��CO��CO2��1��OmoI����Ӧ��10 min��ﵽƽ�⡣
(1)��ʱ�䷶Χ�ڵ�ƽ����Ӧ����v(CO2��=_________mol/L min
min
(2) �����ת����_________________��
(3)�����CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��_______________��
| A������Fe���� | B������Fe2O3���� |
| C�����߷�Ӧ�¶� | D���Ƴ�����CO2 |
����֪��ѧ��Ӧ�٣�Fe��s��+CO2��g��
 FeO��s��+CO��g������ƽ�ⳣ��ΪK1����ѧ��Ӧ�ڣ�Fe��s��+H2O��g��
FeO��s��+CO��g������ƽ�ⳣ��ΪK1����ѧ��Ӧ�ڣ�Fe��s��+H2O��g�� FeO��s��+H2��g������ƽ�ⳣ��K2�����¶�973K��1173K����£�K1��K2��ֵ�ֱ����£�
FeO��s��+H2��g������ƽ�ⳣ��K2�����¶�973K��1173K����£�K1��K2��ֵ�ֱ����£�| �¶� | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(4)ͨ�������е���ֵ�����ƶϣ���Ӧ�ٵġ�H_ O�����>����<����
(5)���з�Ӧ�ۣ��÷�Ӧ��ƽ�ⳣ������ѧ��
��ʽK3=____��
(6)���ݷ�Ӧ�ٺ͢ڿ����Ƶ���Ki��Kz����֮��Ĺ�ϵʽ��K3=__________���ݴ˹�ϵʽ���ϱ����ݣ�Ҳ���ƶϳ���Ӧ�۵ġ�H_ _0(�>����<��)��
(14��)��ҵ���������Ҫ��Ӧ��4NH3(g)+5O2(g)  4NO(g)+6H2O(g)��H=-akJ/mol(a��0)
4NO(g)+6H2O(g)��H=-akJ/mol(a��0)
(1)�����4molNH3��5molO2���������У��ﵽƽ��ʱ���ų�����0.8akJ����Ӧʱת�Ƶĵ�����Ϊ
mol
(2)�������������䣬���й�ϵͼ�д������ ��ѡ����ţ�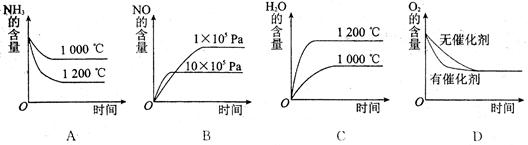
(3)t��ʱ�����ݻ��̶����ܱ������з���������Ӧ�������ڸ����ʵ�Ũ�����±�
| Ũ��(mol/L) ʱ��(min) | c(NH3) | c(O2) | c(NO) | c(H2O) |
| �� ʼ | 4.0 | 5.5 | 0 | 0 |
| ��2min | 3.2 | x | 0.8 | 1.2 |
| ��4min | 2.0 | 3.0 | 2.0 | 3.0 |
| ��6min | 2.0 | 3.0 | 2.0 | 3.0 |
�ٷ�Ӧ�ڵ�2mim����4mimʱ����Ӧ����v(O2)=
�ڵ�2minʱ�ı����������ı������������
A�������¶� B��ʹ���˴��� C����Сѹǿ D��������������
������ͬ���¶��£���ʼ�������м���NH3��O2��NO��H2O(g)��Ũ�ȶ�Ϊ1mol/L����÷�Ӧ���� _______�������(�����Ӧ��.���淴Ӧ��.�����ƶ���)
��4����ҵ����ˮ���ն��������������ᣬ���ɵ�NO2���徭��������������յ�ѭ������ʹ����ת��Ϊ���ᣨ�ٶ�������������������ʧ��������23��NO2����2���������յõ�20�G��ϡ���� �֡�
��5����Ʒ�����Ũ��Ϊ60%��70%��Ϊ����Ũ���ᣬ����Mg(NO3)2����ˮ����Ȼ�����������CaCl2��MgCl2����ˮ����ԭ����__________________________________________
��֪��CO(g)+H2O(g)  CO2(g)+H2(g) ��H=Q����ƽ�ⳣ�����¶ȱ仯���±���ʾ��
CO2(g)+H2(g) ��H=Q����ƽ�ⳣ�����¶ȱ仯���±���ʾ��
| �¶�/�� | 400 | 500 | 850 |
| ƽ�ⳣ�� | 9.94 | 9 | 1 |
��1��������Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ ���÷�Ӧ��Q 0��
��2��850��ʱ�����Ϊ10L��Ӧ���У�ͨ��һ������CO��H2O(g)������������Ӧ��CO��H2O(g)Ũ�ȱ仯��ͼ��ʾ����0~4minʱƽ����Ӧ����v(CO)= ��
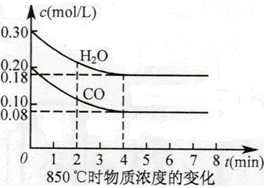
��3������500 ��ʱ���У���CO��H2O(g)����ʼŨ�Ⱦ�Ϊ0.020mol/L���������£�CO�����ת����Ϊ ��
��4������850��ʱ���У�����ʼʱCO��H2O(g)��Ϊ1mol������ˮ�������������Ϊxƽ��ʱCO��ת����Ϊy�����Ƶ�y��x�仯�ĺ�����ϵʽΪ ��
��5��ij�绯ѧװ�ÿ�ʵ��2CO2=2CO+O2��ת����ʹCO�ظ�ʹ�á���֪�÷�Ӧ������ӦΪ4OH--4e-=2H2O+O2����������ӦʽΪ ��
��6���������������Ʒ�Ӧ2CO=2C+O2(��H>0)������CO����Ⱦ�����ж�������Ӧ�ܷ��� (����ܡ������ܡ�)�������� ��
 2C(g)��һ���ܱ������дﵽƽ��ʱ,���c(A2)=0��5mol��L-1��c(B2)=0��1mol��L-1��c(C)=1��6mol��L-1����
2C(g)��һ���ܱ������дﵽƽ��ʱ,���c(A2)=0��5mol��L-1��c(B2)=0��1mol��L-1��c(C)=1��6mol��L-1����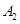 ��
��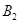 ��C����ʼŨ�ȷֱ�Ϊa mol��L-1��b mol��L-1��g mol��L-1��ȷ����
��C����ʼŨ�ȷֱ�Ϊa mol��L-1��b mol��L-1��g mol��L-1��ȷ����
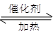 4NH3 (g)+3O2 (g)+ Q����
4NH3 (g)+3O2 (g)+ Q����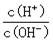
 2NH3(g)+92.4 kJ/mol673K��30MPa�£������ϳɰ���Ӧ��n(NH3)��n(H2)��ʱ��仯�Ĺ�ϵ����ͼ��ʾ��
2NH3(g)+92.4 kJ/mol673K��30MPa�£������ϳɰ���Ӧ��n(NH3)��n(H2)��ʱ��仯�Ĺ�ϵ����ͼ��ʾ��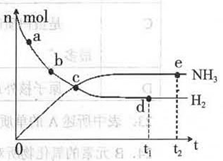
 CH3OH(g)+H2O(g)����ͼ1��ʾ�÷�Ӧ����������(��λΪkJ��mol-1)�ı仯��
CH3OH(g)+H2O(g)����ͼ1��ʾ�÷�Ӧ����������(��λΪkJ��mol-1)�ı仯��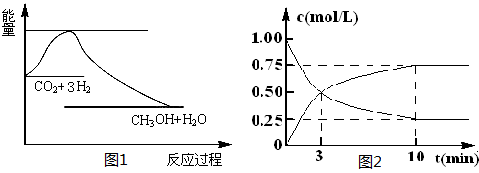
 CO2��H2���ﵽƽ��ʱ��K��
CO2��H2���ﵽƽ��ʱ��K��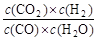 ��K�dz�����ֻ���¶��йأ���Ũ���ء�
��K�dz�����ֻ���¶��йأ���Ũ���ء�