题目内容
已知某条件下,合成氨反应的数据如下:
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
起始浓度/mol·L-1 1.0 3.0 0.2
2s末浓度/mol·L-1 0.6 1.8 1.0
4s末浓度/mol·L-1 0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是( )
| A.2s末氨气的反应速率=0.4mol·(L·s)-1 |
| B.前2s时间内氨气的平均反应速率=0.4mol·(L·s)-1 |
| C.前4s时间内氨气的平均反应速率=0.3mol·(L·s)-1 |
| D.2s~4s时间内氨气的平均反应速率=0.2mol·(L·s)-1 |
A
解析

练习册系列答案
相关题目
已知反应 △H<O,下列说法正确的( )。
△H<O,下列说法正确的( )。
| A.升高温度,正向反应速率增加,逆向反应速率减小 |
| B.升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
| D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
可逆反应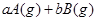
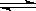
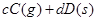
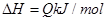 ,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示。据图分析,以下说法正确的是( )
,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示。据图分析,以下说法正确的是( )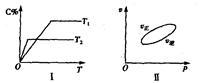
| A.T1<T2,Q>0 |
| B.增大压强,物质B的转化率增大 |
| C.反应达平衡后,增加少量的D,平衡逆向移动 |
| D.a+b>c+d |
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
| A.①② | B.①④ | C.②③ | D.③④ |
下列对可逆反应的认识正确的是( )
| A.SO2+Br2+2H2O=H2SO4+2HBr与2HBr+H2SO4(浓)=Br2+SO2↑+2H2O互为可逆反应 |
| B.既能向正反应方向进行,又能向逆反应方向进行的反应叫可逆反应 |
| C.在同一条件下,同时向正、逆两个方向进行的反应叫可逆反应 |
| D.电解水生成氢气和氧气与氢气和氧气点燃生成水的反应是可逆反应 |
下列关于物质“反应程度”的说法正确的是( )
| A.一定条件下,2molsO2与足量O2反应可得到2molsO3 |
| B.含4mol HCl的浓盐酸与足量的MnO2加热反应可制备1mol Cl2 |
| C.10mL 18.0mol/L H2SO4与足量铜加热反应可制备0.09molsO2 |
| D.一定条件下,1mol N2与3mol H2反应可制备1.0mol NH3 |
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到右上图,则曲线a、b、c、d所对应的实验组别可能是( )
| 组别 | c(HCl)(mol·L-1) | 温度(℃) | 状态 |
| 1 | 2.0 | 25 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.5 | 50 | 块状 |
| 4 | 2.5 | 30 | 粉末状 |
A.4、3、2、1 B.1、2、3、4
C.3、4、2、1 D.1、2、4、3
在一定条件下的恒容密闭容器中发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化。下列有关说法正确的是( )
CH3OH(g)+H2O(g),图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化。下列有关说法正确的是( )
| A.该反应的焓变和熵变:ΔH>0,ΔS<0 |
| B.温度降低,该反应的平衡常数K增大 |
| C.升高温度,n(CH3OH)/n(CO2)增大 |
| D.从反应开始到平衡,用氢气表示的平均反应速率为2.25 mol/(L·min) |