题目内容
体积相同浓度均为0.1mol·L-1的NaOH溶液、氨水,分别稀释m倍、n倍,溶液的pH都变成9,则m和n的关系正确的是
| A.m>n | B.m=n | C.m<n | D.不能确定 |
A
解析试题分析:一水合氨是弱电解质,不能完全电离,物质的量浓度相同的NaOH和氨水,NaOH的pH大,如稀释相同倍数,稀释后的溶液仍是氢氧化钠pH大,如稀释后溶液的pH相等,则氢氧化钠应加入较多的水,则m>n,故选A.。
考点:考查弱电解质的电离,侧重于学生的分析能力的考查和基本理论知识的综合运用,为高频高频考点,注意把握弱电解质的电离特点,难度不大.。

练习册系列答案
相关题目
下列事实中不能证明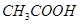 是弱电解质的是
是弱电解质的是
A.常温下某 |
B.常温下0.1mol 溶液的pH=2.8 溶液的pH=2.8 |
C. 溶液与稀盐酸反应生成 溶液与稀盐酸反应生成 |
D.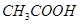 属于共价化合物 属于共价化合物 |
物质的量浓度相同的下列溶液中,符合按pH由小到大的顺序排列的是
| A.Na2CO3 NaHCO3 NaCl NH4Cl | B.Na2CO3 NaHCO3 NH4Cl NaCl |
| C.(NH4)2SO4 NH4Cl NaNO3 Na2S | D.NH4Cl (NH4)2SO4 Na2S NaNO3 |
下列说法不正确的是
| A.Ksp只与难溶电解质的性质和温度有关 |
| B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C.其他条件不变,离子浓度改变时,Ksp不变 |
| D.两种难溶电解质作比较时,Ksp小的,溶解度一定小 |
在一定条件下,Na2CO3溶液中存在CO32-+H2O HCO3-+OH-平衡。下列说法不正确的是( )
HCO3-+OH-平衡。下列说法不正确的是( )
A.稀释溶液, 减小 减小 | B.加入NaOH固体, 减小 减小 |
| C.升高温度,平衡常数增大 | D.通入CO2,溶液pH减小 |
关于pH相同的醋酸和盐酸,下列叙述正确的是
| A.取等体积的醋酸和盐酸,分别稀释至原溶液的m倍和n倍,结果两溶液的pH仍然相同,则m<n |
| B.取等体积的两种酸分别与完全一样的足量锌粒反应,开始时反应速率:盐酸大于醋酸 |
| C.取等体积的两种酸,分别用完全一样的NaOH溶液进行中和,醋酸消耗NaOH的物质的量比盐酸消耗的多 |
| D.两种酸中c (CH3COO-) > c (Cl-) |
下列能正确表示水解的离子方程式是
A.CH3COOH + H2O  CH3COO- + H3O+ CH3COO- + H3O+ |
B.Br- + H2O  HBr + OH- HBr + OH- |
C.CO32- + 2H2O H2CO3 + 2OH- H2CO3 + 2OH- |
D.NH4+ + H2O  NH3·H2O + H+ NH3·H2O + H+ |
某温度下,向一定体积的0.1mol/L醋酸溶液中逐滴加入0.1mol/LNaOH溶液,溶液中pOH【注:pOH=-lgc(OH-)】与pH的变化关系如图所示,则下列说法中正确的是
| A.M点所示溶液中c(Na+)﹥c(CH3COO-)﹥c(OH-)﹥c(H+) |
| B.N点所示溶液中c(CH3COO-)﹥c(Na+) |
| C.M点和N点所示溶液中水的电离程度相同 |
| D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |