题目内容
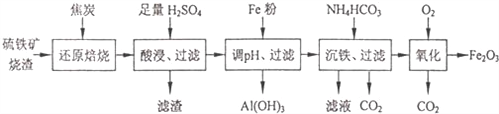
【题目】某铜矿石的主要成分是Cu2O,还含有少量的Al2O3、Fe2O3和SiO2。某工厂利用此矿石炼制精铜的工艺流程如图所示(已知:Cu2O+2H+===Cu+Cu2++H2O)。
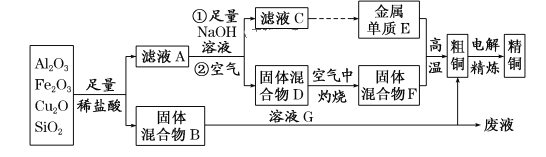
(1)滤液A中铁元素的存在形式为______________(填离子符号),生成该离子的离子方程式为_______________,检验滤液A中存在该离子的试剂为___________(填试剂名称)。
(2)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为_________________________,在实验室中完成此实验还需要的试剂是________。
a.KClO3 b.KCl c.Mg d.MnO2
(3)为使固体混合物D在空气中灼烧完全分解,应_____________,直至连续两次测定的实验结果相同(或质量相差小于0.1 g)时为止;灼烧时必须用到的实验仪器是__________。
(4)溶液G与固体混合物B反应的离子方程式为__________________________。
(5)将Na2CO3溶液滴入到一定量的CuCl2溶液中,得到氯化钠、二氧化碳和一种绿色的不溶于水的盐(不含结晶水),该盐受热分解产生三种氧化物,则该盐的化学式是______。
【答案】Fe2+ 2Fe3++Cu=2Fe2++Cu2+ 2Al+Fe2O3![]() Al2O3+2Fe ac 灼烧,冷却至室温后称重,重复多次 坩埚 SiO2+2OH-=SiO32-+H2O Cu2(OH)2CO3[或Cu(OH)2·CuCO3]
Al2O3+2Fe ac 灼烧,冷却至室温后称重,重复多次 坩埚 SiO2+2OH-=SiO32-+H2O Cu2(OH)2CO3[或Cu(OH)2·CuCO3]
【解析】
(1)Cu2O与盐酸反应生成氯化铜、铜和水,Fe2O3和盐酸反应生成氯化铁和水,铜和氯化铁反应生成氯化亚铁和氯化铜,所以滤液A中铁元素的存在形式为Fe2+,生成该离子的离子反应方程式为:2Fe3++Cu=2Fe2++Cu2+;(2)金属E与固体F发生的某一反应可用于焊接钢轨,该反应是铝热反应,反应的化学方程式为:2Al+Fe2O3![]() Al2O3+2Fe;在实验室中完成此实验还需要的试剂是KClO3和Mg;答案选ac;(3)为使固体混合物D在空气中灼烧完全分解,应冷却至室温后称重,重复多次,直至连续两次测定的实验结果相同(或质量相差小于0.1g)时为止;灼烧时必须用到的实验仪器是坩埚;(4)固体混合物B是铜和二氧化硅的混合物,由图可知,溶液G与固体混合物B反应制得粗铜,即溶液G只能和二氧化硅反应,可用氢氧化钠溶液,反应的离子反应方程式为:SiO2+2OH-=SiO32-+H2O;(5)将Na2CO3溶液滴入到一定量的CuCl2溶液中,得到氯化钠、二氧化碳和一种绿色的不溶于水的盐(不含结晶水),该盐受热分解产生三种氧化物,说明该盐是含铜离子的复盐,其化学式是Cu2(OH)2CO3或Cu(OH)2·CuCO3。
Al2O3+2Fe;在实验室中完成此实验还需要的试剂是KClO3和Mg;答案选ac;(3)为使固体混合物D在空气中灼烧完全分解,应冷却至室温后称重,重复多次,直至连续两次测定的实验结果相同(或质量相差小于0.1g)时为止;灼烧时必须用到的实验仪器是坩埚;(4)固体混合物B是铜和二氧化硅的混合物,由图可知,溶液G与固体混合物B反应制得粗铜,即溶液G只能和二氧化硅反应,可用氢氧化钠溶液,反应的离子反应方程式为:SiO2+2OH-=SiO32-+H2O;(5)将Na2CO3溶液滴入到一定量的CuCl2溶液中,得到氯化钠、二氧化碳和一种绿色的不溶于水的盐(不含结晶水),该盐受热分解产生三种氧化物,说明该盐是含铜离子的复盐,其化学式是Cu2(OH)2CO3或Cu(OH)2·CuCO3。

【题目】如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。
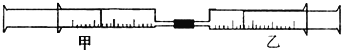
实验序号 | 甲针筒内物质 | 乙针筒内物质 |
1 | 溴水 | SO2 |
2 | H2S | SO2 |
3 | NO2(主要) | H2O(l) |
4 | 15mLCl2 | 40mLNH3 |
试回答下列问题:
(1)实验1中,溶液颜色由______色变为______色,写出溶液变色的化学反应方程式____________。
(2)实验2甲针筒内发生的化学反应方程式:_______________。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入________溶液中。
(3)实验3中,甲中最后剩余的无色气体是_____,写出NO2与H2O反应的化学反应方程式_____________。
(4)实验4中能看见有白烟产生并生成一种气体(空气主要成分之一),该化学反应方程式______________,写出检验所得白色固体中阳离子的操作方法:___________。