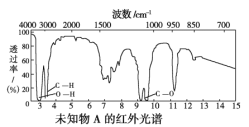
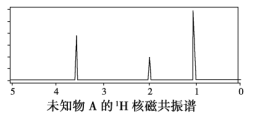
题目内容
【题目】海水中化学资源的综合开发利用,已受到各国的高度重视。Br2和Mg等两种单质都可以从海水中提取,如图为提取它们的主要步骤:
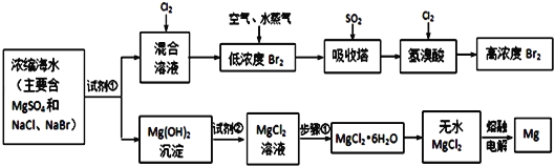
请回答:
Ⅰ.从海水中提取的溴占世界溴年产量的三分之一,主要方法就是上述流程中的空气吹出法。
(1)制取Br2时第一次通入Cl2时发生反应的离子方程式是_________。
(2)吸收塔中反应的离子方程式是_______,工业生产1mol Br2,理论上需要Cl2的物质的量为______ 。
(3)取10L海水经过提纯浓缩,向吸收塔吸收后的溶液中加入0.100mol/L AgNO3溶液8.0mL恰好完全反应,则海水中含溴的含量为______ mg/L(不考虑提纯过程中溴的损失)。
Ⅱ.镁及其合金是用途很广的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用__________ (写化学式)。
(2)步骤①包括加热、蒸发、冷却、结晶、____________。
(3)通电时无水MgCl2在熔融状态下反应的化学方程式是_______________。
【答案】2Br-+Cl2=2Cl-+Br2 SO2+2H2O+Br 2=4H++2 Br-+SO42- 2mol 6.4 Ca(OH)2 过滤 MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
【解析】
浓缩海水中主要含MgSO4、NaCl、NaBr,加入试剂氢氧化钙或氢氧化钠沉淀镁离子,过滤得到混合溶液中通入氯气,得到低浓度的溴单质,进入吸收塔用二氧化硫吸收得到溴化氢,再通入氯气得到高浓度的溴单质,氢氧化镁沉淀中加入盐酸溶液溶解得到氯化镁溶液,加热、蒸发、冷却、结晶、过滤得到氯化镁晶体,在氯化氢气流中加热失去结晶水得到氯化镁固体,电解熔融氯化镁得到镁和氯气。
由上述分析可知:
I.(1)浓缩海水与试剂①反应得到氢氧化镁,剩余混合液中含有的是溴离子,通入氯气后,氯气与溴离子反应生成单质溴和氯离子,其离子方程式是Cl2+2Br-═2 Cl-+Br2;答案为:Cl2+2Br-═2 Cl-+Br2。
(2)单质溴经过空气吹出法后被富集在吸收塔,通入的二氧化硫与单质溴反应生成硫酸和氢溴酸,其化学方程式是:Br2+SO2+2H2O═2H2SO4+2HBr,即其离子方程式为Br2+SO2+2H2O═4H++SO42-+2 Br-;由①Cl2+2Br-═2 Cl-+Br2,②Br2+SO2+2H2O═4H++SO42-+2 Br-,③Cl2+2Br-═2 Cl-+Br2,可知工业生产1mol Br2,需要2molCl2;答案为Br2+SO2+2H2O═4H++SO42-+2 Br-,2mol。
(3)由反应Ag++Cl-=AgCl↓,Cl2+2Br-═2 Cl-+Br2,可知n(Ag+)~n(Cl-)~n(Br-),由银元素的物质的量为0.1mol/L×8×10-3L=0.8×10-3mol,则溴元素的物质的量也为0.8×10-3mol,溴元素的质量为0.8×10-3mol×80g/mol=64×10-3g=64mg,则海水中含溴的含量为![]() =6.4mg/L;答案为6.4mg/L。
=6.4mg/L;答案为6.4mg/L。
II.(1)为了使MgSO4转化为Mg(OH)2,从经济理念出发,试剂①可以选用由海洋中的贝壳得到的固体Ca(OH)2使MgSO4完全转化为沉淀;答案为Ca(OH)2。
(2)要从氯化镁溶液得到含结晶水的氯化镁,就需要蒸发、冷却、结晶,并通过过滤把固体从溶液中分离出来;答案为过滤。
(3)氯化镁电解为分解反应,产物为镁和氯气,所以电解方程式为:MgCl2(熔融)![]() Mg+Cl2↑;答案为MgCl2(熔融)
Mg+Cl2↑;答案为MgCl2(熔融)![]() Mg+Cl2↑。
Mg+Cl2↑。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】下列实验方案中,不能达到相应实验目的的是
A | B | C | D | |
方案 |
|
|
|
|
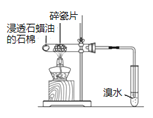
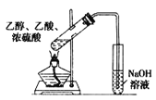
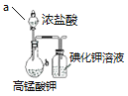
目的 | 验证不同催化剂对化学反应速率的影响 | 验证石蜡油分解的产物中含有与烷烃性质不同的烃 | 制备乙酸乙酯 | 比较Cl2、I2的氧化性 |
A.AB.BC.CD.D