题目内容
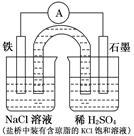
某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。
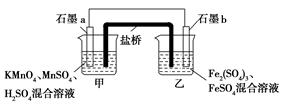
回答下列问题:
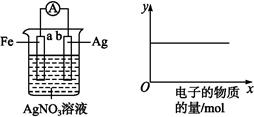
(1)此原电池的正极是石墨 (填“a”或“b”),发生 反应。
(2)电池工作时,盐桥中的SO42-移向 (填“甲”或“乙”)烧杯。
(3)两烧杯中的电极反应式分别为:甲 ,乙 。
(4)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为 mol。

回答下列问题:
(1)此原电池的正极是石墨 (填“a”或“b”),发生 反应。
(2)电池工作时,盐桥中的SO42-移向 (填“甲”或“乙”)烧杯。
(3)两烧杯中的电极反应式分别为:甲 ,乙 。
(4)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为 mol。
(1)a 还原 (2)乙
(3)MnO4-+5e-+8H+=Mn2++4H2O 5Fe2+-5e-=5Fe3+
(4)0.5
(3)MnO4-+5e-+8H+=Mn2++4H2O 5Fe2+-5e-=5Fe3+
(4)0.5
(1)根据题目提供的总反应方程式可知,KMnO4作氧化剂,发生还原反应,故石墨a是正极。(2)电池工作时,SO42-向负极移动,即向乙烧杯移动。(3)甲烧杯中的电极反应式为MnO4-+5e-+8H+=Mn2++4H2O;乙烧杯中的电极反应式为5Fe2+-5e-=5Fe3+。(4)溶液中的MnSO4浓度由1 mol·L-1变为1.5 mol ·L-1,由于溶液的体积未变,则反应过程中生成的MnSO4的物质的量为0.5 mol·L-1×0.2 L=0.1 mol,转移的电子为0.1 mol×5=0.5 mol。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目