��Ŀ����
����Ŀ������ͭ��һ��Ӧ�ü���㷺�Ļ���ԭ�ϣ�������ij�����ú�����ͭΪԭ������������CuSO45H2O������������ʾ��ͼ�� 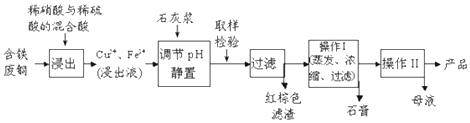
������ʯ���ڲ�ͬ�¶��µ��ܽ�ȣ�g/100gˮ��������
�¶ȣ��棩 | 20 | 40 | 60 | 80 | 100 |
ʯ�� | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
���� | 32 | 44.6 | 61.8 | 83.8 | 114 |
��ش��������⣺
��1������ɫ��������Ҫ�ɷ�����
��2��д��������������������ͭ�Ļ�ѧ����ʽ��
��3������I�IJ����¶�Ӧ�ÿ����������ң�
��4������Һ�з��������ͭ����IJ���IIӦΪϴ�ӡ����
��5����Ӧ�����е�NO����ѭ��ʹ�ã��Խ���һ����ѧ����ʽ��ʾNOת��ΪHNO3��
���𰸡�
��1��Fe��OH��3
��2��3Cu+2HNO3+3H2SO4=3CuSO4+2NO��+4H2O
��3��100
��4����ȴ�ᾧ������
��5��4NO+3O2+H2O=4HNO3
���������⣺�����ķ�ͭΪԭ�ϼ���ϡ�����ϡ����Ļ����Һ���ܽ��õ�����Һ���ڽ���Һ����Ҫ����Cu2+��Fe3+��H+��SO42�� �� ����ʯ�ҽ�������ҺPH���������ӣ����˵õ����ɫ����Ϊ������������������ʯ����������ܽ�ȣ�����100��C����Һ������ʯ�࣬��Һ����ҪΪ����ͭ��ͨ����������Ũ������ȴ�ᾧ������ϴ�ӣ�����õ�����ͭ���壻��1���ɹ�������ͼת����ϵ��֪������Һ�м���ʯ�ҽ�����pHֵ��������ת��ΪFe��OH��3�������������ɫ��������Ҫ�ɷ�ΪFe��OH��3 �� ���Դ��ǣ�Fe��OH��3����2����������Ĵ��ڣ��������������ȫ�����������ã���Ϊϡ��Һ����������ͭ��NO��ˮ����Ӧ����ʽΪ3Cu+2HNO3+3H2SO4=3CuSO4+2NO��+4H2O�����Դ��ǣ�3Cu+2HNO3+3H2SO4=3CuSO4+2NO��+4H2O����3���ɱ����ܽ�ȹ�ϵ��֪�������ܽ�����¶���������ʯ����ܽ�����¶����߽��ͣ�����Ӧ�����ڽϸߵ��¶ȣ��¶�Ӧ�ÿ�����100�棬�Ʊ��ĵ�����Խϴ���
���Դ��ǣ�100����4������Һ�з��������ͭ����ӦΪ������Һ��ȴ�ᾧ�����ˡ�ϴ�ӡ�������Դ��ǣ���ȴ�ᾧ�����ˣ���5��һ�����������ж���Ⱦ���������ŷŵ������У���������һ��������������ˮ��Һ��������������ѭ��ʹ�÷�Ӧ�Ļ�ѧ����ʽ4NO+3O2+H2O=4HNO3 �� ���Դ��ǣ�4NO+3O2+H2O=4HNO3 ��

����Ŀ������ʵ�������ͼ����Ϣ���ܳ��˵����Ӧ�Ļ�ѧ��Ӧ�Ƿ��ȷ�Ӧ���ǣ� ��
A�� | B�� | C�� | D�� | |
��Ӧ |
|
|
|
|
ʵ������ | �¶ȼƵ�ˮ������������ | ��Ӧ������������������������ | ��Ӧ��ʼ�״�Һ������Ҵ�Һ�� | ��Ӧ��ʼ����Ͳ���������ƶ� |
A.A
B.B
C.C
D.D






