题目内容
【题目】(1)同温同压下,![]() 与
与![]() (均为气体),它们的体积之比为_____________,它们的质量之比为_____________。
(均为气体),它们的体积之比为_____________,它们的质量之比为_____________。
(2)3.80g![]() 含有0.08mol
含有0.08mol![]() ,
,![]() 的摩尔质量为_____________,若M原子中质子数与中子数相等,该物质的化学式为_____________。
的摩尔质量为_____________,若M原子中质子数与中子数相等,该物质的化学式为_____________。
(3)某化学社团的同学对仅由两种元素组成的化合物X进行研究,实验过程形成如图示:
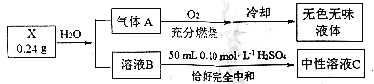
已知:A为单质,B的焰色反应只显示黄色。
写出X与水反应的化学方程式_______________________________________。
【答案】2:3 1:1 ![]() MgCl2
MgCl2 ![]()
【解析】
(1)同温同压下,气体的摩尔体积相同,根据m=nM进行计算比较;
(2)摩尔质量=![]() ;质子数+中子数=质量数;
;质子数+中子数=质量数;
(3)B的焰色反应只显示黄色说明含有Na元素,能与50mL0.1mol/L的硫酸溶液恰好中和说明B溶液显碱性;气体A在氧气中燃烧生成无色无味液体,可推测A为氢气,所以X所含的两种元素为H和Na,可先猜测其化学式为NaH,则 0.24gNaH的物质的量为![]() ,生成的B溶液为氢氧化钠,氢氧化钠的物质的量为0.01mol,50mL0.1mol/L的硫酸溶液中氢离子物质的量为0.01mol,恰好与氢氧化钠完全反应,符合题意,即猜想成立,X为NaH。
,生成的B溶液为氢氧化钠,氢氧化钠的物质的量为0.01mol,50mL0.1mol/L的硫酸溶液中氢离子物质的量为0.01mol,恰好与氢氧化钠完全反应,符合题意,即猜想成立,X为NaH。
(1)同温同压下,气体的摩尔体积相同,所以体积之比等于物质的量之比,![]() 与
与![]() (均为气体),它们的体积之比为0.4:0.6=2:3;
(均为气体),它们的体积之比为0.4:0.6=2:3;![]() 的质量为0.4mol×48g/mol=19.2g,
的质量为0.4mol×48g/mol=19.2g,![]() 的质量为0.6mol×32g/mol=19.2g它们的质量之比为1:1。
的质量为0.6mol×32g/mol=19.2g它们的质量之比为1:1。
(2)3.80g![]() 含有0.08mol
含有0.08mol![]() ,则
,则![]() 的物质的量为0.04mol,
的物质的量为0.04mol,![]() 的摩尔质量=
的摩尔质量=![]() ,M的质量数为95-35.5×2=24,M原子中质子数与中子数相等,质量数=质子数+中子数,所以该原子的质子数为12,即Mg,所以物质的化学式为MgCl2;
,M的质量数为95-35.5×2=24,M原子中质子数与中子数相等,质量数=质子数+中子数,所以该原子的质子数为12,即Mg,所以物质的化学式为MgCl2;
(3)根据分析可知X为NaH,其与水反应生成氢氧化钠和氢气,方程式为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案