题目内容
工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下:

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
请回答下列问题:
(1)酸浸前将碳酸锰矿粉碎的作用是__________________。
(2)酸浸后的溶液中含有Mn2+、SO42—,另含有少量Fe2+、Fe3+、Al3+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其离子反应方程式为__________________________。
②加入CaO将溶液的pH调到5.2~6.0,其主要目的是
_____________________________________________________________。
③加入BaS,除去Cu2+、Pb2+后,再加入NaF溶液,除去______________________。
(3)从溶液A中回收的主要物质是________________,该物质常用作化肥。
(4)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2。写出Mn3O4与稀硫酸反应的化学方程式:______________________________。

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Pb(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 8.0 | 8.3 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.8 | 9.8 |
请回答下列问题:
(1)酸浸前将碳酸锰矿粉碎的作用是__________________。
(2)酸浸后的溶液中含有Mn2+、SO42—,另含有少量Fe2+、Fe3+、Al3+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其离子反应方程式为__________________________。
②加入CaO将溶液的pH调到5.2~6.0,其主要目的是
_____________________________________________________________。
③加入BaS,除去Cu2+、Pb2+后,再加入NaF溶液,除去______________________。
(3)从溶液A中回收的主要物质是________________,该物质常用作化肥。
(4)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2。写出Mn3O4与稀硫酸反应的化学方程式:______________________________。
(1)增大接触面积,加快反应速率(使反应更充分)
(2)①2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
②除去Fe3+、Al3+ ③Ca2+
(3)(NH4)2SO4
(4)Mn3O4+2H2SO4=2MnSO4+MnO2+2H2O
(2)①2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
②除去Fe3+、Al3+ ③Ca2+
(3)(NH4)2SO4
(4)Mn3O4+2H2SO4=2MnSO4+MnO2+2H2O
(1)将碳酸锰矿粉碎,可以增大与H2SO4的接触面积,加快化学反应速率。(2)根据沉淀时的pH值,应把Fe2+氧化;加入CaO和H+反应,增大pH到5.2~6.0可使Al3+、Fe3+完全转化为Al(OH)3、Fe(OH)3沉淀,除去Fe3+、Al3+;调节pH值时,加入了CaO,为了除去Ca2+,应加入NaF,使之生成CaF2沉淀。
(3)溶液A中的阴离子为SO42—,所以加NH4HCO3后,生成的主要物质是(NH4)2SO4,作为氮肥用。
(4)Mn3O4+2H2SO4=2MnSO4+MnO2+2H2O (用倒配法配平,Mn3O4中Mn的化合价为+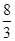 )。
)。
(3)溶液A中的阴离子为SO42—,所以加NH4HCO3后,生成的主要物质是(NH4)2SO4,作为氮肥用。
(4)Mn3O4+2H2SO4=2MnSO4+MnO2+2H2O (用倒配法配平,Mn3O4中Mn的化合价为+
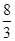 )。
)。
练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目

 的溶液中肯定不存在Ag+
的溶液中肯定不存在Ag+ Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小
Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小

 AgBr(s)+Cl-(aq)平衡常数K≈816
AgBr(s)+Cl-(aq)平衡常数K≈816
