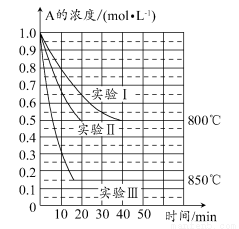
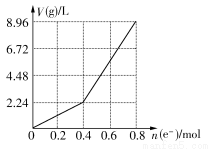
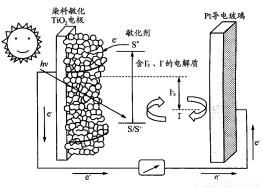
题目内容
向足量H2SO4溶液中加入100mL 0.4 mol·L-1Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4 mol·L-1HCl溶液时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为 ( )
A.Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-2.92 kJ·mol-1
B.Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-18 kJ·mol-1
C.Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-73 kJ·mol-1
D.Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-0.72 kJ·mol-1
B
【解析】根据题述条件可得如下热化学方程式:Ba2+(aq)+2OH-(aq)+2H+(aq)+SO42—(aq)=BaSO4(s)+2H2O(l);ΔH=-128 kJ·mol-1①,OH-(aq)+H+(aq)=H2O(l);ΔH=-55 kJ·mol-1②,根据盖斯定律:①-2×②可得:Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-18 kJ·mol-1。

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目