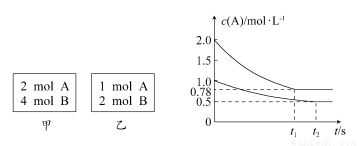
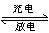
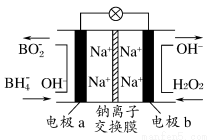
题目内容
已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g) CO(g)+H2(g);②C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
CO(g)+H2(g);②C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2 (g);ΔH=-393.5 kJ·mol-1
CO(g)+1/2O2(g)=CO2(g);ΔH=-283.0 kJ·mol-1
H2(g)+1/2O2(g)=H2O(g);ΔH=-242.0 kJ·mol-1
请回答:
(1)根据以上信息,写出CO与水蒸气反应的热化学方程式:____________________________。

(2)如图是根据盖斯定律做出的循环图,根据图的转化关系和热化学方程式计算ΔH3=________kJ/mol。
请比较ΔH1与ΔH3数值是否可以说明用水煤气做燃料要比直接燃煤放出的热量多________(是或否)原因是___________________________________。
(3)目前煤的运输还主要靠铁路运输和公路运输,你能在所学知识基础上提出缓解铁路和公路运输的方法:____________________________。
(1)CO(g)+H2O(g)=CO2(g)+H2(g),ΔH=-41.0 kJ/mol
(2)否 根据盖斯定律没有计算ΔH2吸收的热量
(3)将煤变为水煤气后管道运输
【解析】(1)CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.0 kJ/mol
(2)ΔH3=-525.0 kJ/mol ΔH1=-393.5 kJ/mol,不能因为ΔH3数值大于ΔH1就说明水煤气做燃料放出热量多,因为还原,ΔH2的热量没有计算。
(3)将煤变为水煤气后用管道运输,可缓解铁路和公路运输压力。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案X、Y、Z、W是短周期的四种元素,有关他们的信息如表所示。
元素 | 部分结构知识 | 部分性质 |
X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
填写下列空白(不能用字母X、Y、Z、W作答)。
(1)X的气态氢化物分子的电子式是 ,Z元素在周期表中的位置是 。
(2)X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是 。
(3)常温时,W的硫酸盐溶液的pH (填“>”、“<”或“=”)7,理由是: (用离子方程式表示)。
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是(用离子方程式表示) 。
(5)25℃、101 kPa时,32 g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6kJ的热量,写出该反应的热化学方程式: 。