题目内容
(1)下列化合物中熔点最高的是???????? 。
A.NaCl?? B.KBr?? C.NaF?? D.KI
(2)基态铬(Cr)原子的外围电子排布式是?????????????????????????? ,这样排布使整个体系能量最低,原因是?????????????????????? 。
(3)氨水中存在多种形式的氢键,其中与“氨极易溶于水”这种性质相关的氢键可表示为:? ④? 。
下列各项中与氢键有关的是????????????? 。
a.甘油与水互溶?????????? b.HBr的沸点高于HCl? c .邻羟基苯甲醛的熔点低于对羟基苯甲醛
d.水分子比硫化氢分子稳定?? e.碘在乙醇中的溶解度较大,但不能用乙醇从碘水中萃取碘
(4)下列物质的晶体中含有阳离子的是???????? ,分子中存在π键的是?????? ,既含极性键又含非极性键的是??????????? 。
A.K?? B.H2O2? C.CH3NH2?? D.HCOONa?? E.F2C=CF2?? F.CO2?? G.C2HCl2Br
(5)下列各项的比较中正确的是?????????? 。
A.第一电离能:Mg>Al?? B.电负性:P>Ge?? C.稳定性:AsH3>H2S? D.金属性:20X<30Y
(1)C??
(2)3d54s1???? 3d、4s轨道上的电子均为半充满状态?
(3)O-H…N或N-H…O??????? ace
(4)AD??? EF??? BG?
(5)AB
【解析】
试题分析:(1)四种物质均是离子化合物,形成的晶体均是离子晶体。离子晶体的熔点随晶格能的增大而升高。形成离子晶体的离子半径越小,所带电荷数越大离子键越强,晶格能越大,熔点越高。离子半径是Na+<K+、F-<Cl-<Br-<I-,所以晶格能最大的是氟化钠,因此熔点最高的是氟化钠,答案选C。
(2)铬的原子序数是24,则依据核外电子排布过滤可知,基态铬(Cr)原子的外围电子排布式是3d54s1;由于3d、4s轨道上的电子均为半充满状态,稳定性强,所以这样排布使整个体系能量最低。
(3)由于氮元素的非金属性强,能与水分子中的氢原子形成氢键,所以氨气极易溶于水,氢键可以表示为O-H…N或N-H…O。a.甘油中的氧原子能与水分子中的氢原子形成氢键,因此甘油与水互溶;b.HBr的沸点高于HCl与分子间作用力有关系,与氢键无关;c .邻羟基苯甲醛的熔点低于对羟基苯甲醛,这是由于前者形成分子内氢键,而后者形成分子间氢键;d.水分子比硫化氢分子稳定与氧元素的非金属性强于硫元素有关系,与氢键无关,氢键不能影响分子的稳定性;e.碘在乙醇中的溶解度较大,但不能用乙醇从碘水中萃取碘,这是由于乙醇与分子能形成氢键,与水互溶,所以答案选ace。
(4)K形成的晶体是金属晶体,是由金属阳离子与自由电子形成的;HCOONa形成的晶体是离子晶体,含有金属阳离子,所以晶体中含有阳离子的是金属钾和甲酸钠,答案选AD;π键只能存在于双键或三键中,因此分子中存在π键的是F2C=CF2和CO2 ,答案选EF;由同种非金属元素形成的共价键是非极性键,由不同种非金属元素形成的共价键是极性键,所以既含极性键又含非极性键的是H2O2和C2HCl2Br,答案选BG。
(5)A.金属性越强,第一电离能越小。但由于镁元素的3s广东处于全充满状态,稳定性强,所以第一电离能:Mg>Al,A正确;B.非金属性越强,电负性越大,非金属性是P>As>Ge,则电负性:P>Ge,B正确;C.非金属性越强,氢化物的稳定性越强。非金属性是S>Se>As,所以稳定性:AsH3<H2S,C不正确;D.原子序数为20和30的元素分别是Ca和Zn,则根据金属活动顺序表可知金属性:20X>30Y,D不正确,答案选AB。
考点:考查元素推断、核外电子排布、氢键、第一电离能、电负性、化学键、元素周期律的应用以及晶体结构和的性质的正误判断

| A、该R元素原子的原子核中有82个中子 | B、R是一种柔软的金属,它的熔沸点高于金属钠 | C、X和Y可形成原子个数比为1:1和2:1的化合物 | D、Y、Z和W三种元素形成的化合物的水溶液呈碱性 |
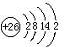
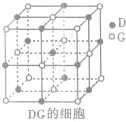 (3)H3+离子在一定条件下能形成结构复杂的配离子[HG(A2C)5]2+形成该配离子时,H3+离子接受了配体提供的
(3)H3+离子在一定条件下能形成结构复杂的配离子[HG(A2C)5]2+形成该配离子时,H3+离子接受了配体提供的 (2011?锦州模拟)【化学--物质结构与性质】
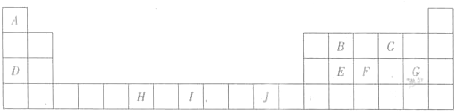
(2011?锦州模拟)【化学--物质结构与性质】 位于元素周期表前四周期的五种元素A、B、C、D、E,原子序数依次增大.A元素原子的最外层电子排布可表示为:asaap2a,B元素在地壳中含量居第二位,C与B位于同一周期,且是该周期元素中电负性最大的元素,D元素的+3价离子的3d亚层为半充满,E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子.
位于元素周期表前四周期的五种元素A、B、C、D、E,原子序数依次增大.A元素原子的最外层电子排布可表示为:asaap2a,B元素在地壳中含量居第二位,C与B位于同一周期,且是该周期元素中电负性最大的元素,D元素的+3价离子的3d亚层为半充满,E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子.