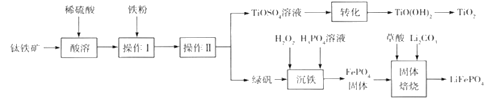
题目内容
【题目】有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4mol淡黄色粉末时,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如下图所示。
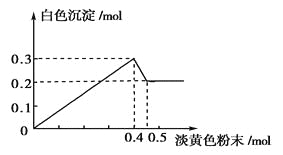
根据题意回答下列问题:
(1)淡黄色粉末为____________(填名称)。
(2)溶液中肯定有______________离子,肯定没有__________离子。
(3)溶液中各离子的物质的量之比为
________________________________________________________________________。
(4)写出下列反应方程式:
①淡黄色粉末与水反应的化学方程式:____________________________________。
②刺激性气味的气体产生的离子方程式:______________________________________。
③沉淀部分减少时的离子方程式:_______________________________________。
【答案】过氧化钠 NH4+、Mg2+、Al3+ Cu2+、Fe3+ n(Mg2+):n(Al3+):n(NH4+)=2:1:1 2Na2O2+2H2O=4NaOH+O2↑ ![]() Al(OH)3+OH-═AlO2-+2H2O
Al(OH)3+OH-═AlO2-+2H2O
【解析】
有一透明溶液,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀,则淡黄色固体为Na2O2,图象中加入0.4mol Na2O2后,沉淀减小,且没有完全溶解,则溶液中一定没有Fe3+和Cu2+,一定有NH4+、Al3+、Mg2+,由图可知Mg(OH)2为0.2mol,Al(OH)3为0.3mol-0.2mol=0.1mol,根据元素守恒计算Al3+、Mg2+物质的量,加入0.4mol Na2O2之后,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,说明此时NH4+完全反应,所以产生气体0.3mol,即为Na2O2与H2O反应生成的O2和NH4+生成的NH3。
(1)由上述分析可知,淡黄色固体为:Na2O2,名称为过氧化钠;
(2)由上述分析可知,溶液中肯定有离子NH4+、Al3+、Mg2+,肯定没有Fe3+和Cu2+离子;
(3)根据纵坐标:n(Mg2+)=n[Mg(OH)2]=0.2mol,n(Al3+)=0.3mol-n[Mg(OH)2]=0.1mol,当n(Na2O2)=0.4mol时,由2Na2O2+2H2O=4NaOH+O2↑,可知n(O2)=0.4mol×1/2=0.2mol,所以n(NH4+)=n(NH3)=0.3mol-n(O2)=0.1mol,n(Mg2+):n(Al3+):n(NH4+)=0.2mol:0.1mol:0.1mol=2:1:1;
(4)①由上述分析可知,淡黄色固体为:Na2O2,与水反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;
②刺激性气味的气体即氨气产生为铵根与氢氧根离子在加热条件下反应生成,离子方程式为:![]() ;
;
③沉淀部分减少即为氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案【题目】Ⅰ.25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11` | 3.0×10-8 |
请回答下列问题:
(1)列出CH3COONa的水解平衡常数Kh的计算式:_________。
(2)物质的量浓度相同的三种溶液:a.CH3COONa b.NaHCO3 c.NaClO
三种溶液的pH由小到大排列的顺序是___<___< ____(用编号填写)。
(3)写出向NaClO溶液中通入少量CO2的化学方程式________。
Ⅱ.(4)碳酸钠溶液呈碱性的原因是:_____________。(写出离子方程式)。0.01mol/L Na2CO3溶液的pH___0.1mol/LNa2CO3溶液的pH。(填“>”或“<”或“=”)
(5)浓度均为0.1mol/L的①CH3COONa溶液②NH4Cl溶液③稀HCl④Na2SO4溶液按pH由大到小的排列顺序为_______。