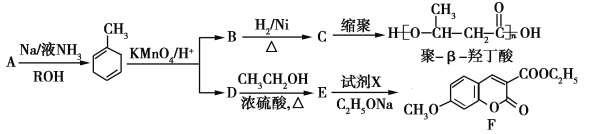
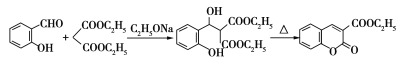
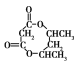
题目内容
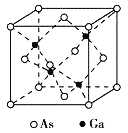
【题目】核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q,其中在同周期中,Z的金属性最强,Q的非金属性最强;W的单质是淡黄色固体;X、Y、W在周期表中的相对位置关系如图所示
(1)五种元素形成的单质,其中固态时属于原子晶体的是________(填化学式);常用作强氧化剂的是________、________(填化学式)。
(2)这五种元素中,原子半径最大的是________(填化学式);由Z、W、Q形成的简单离子半径由大到小的顺序是________(用化学式表示);X、W、Q的最高价氧化物的水化物酸性从强到弱的顺序是________(用化学式表示)。
(3)Y和Z形成的一种化合物中含有离子键和共价键,请用电子书表示该化合物中化学键的形成过程___________________________________。
(4)Z与Q反应生成的化合物属于________化合物;电解该化合物的饱和溶液,阳极的电极反应式为________;电解一段时间后,将阳极产物和阴极溶液混合,反应的化学方程式是______________。
(5)由X、Y和氢三种元素组成的化合物X6H12Y6,已知:9 g该化合物燃烧放出140 kJ的热,写出该化合物燃烧热的热化学方程式:_______________________________。
【答案】 C O2 Cl2 Na S2﹣>Cl﹣>Na+ HClO4>H2SO4>H2CO3 ![]() 离子 2Cl-﹣2e-=Cl2↑ Cl2+2NaOH=NaCl+NaClO+H2O C6H12O6 (s)+6O2(g)=6 CO2(g)+6H2O(l) △H=﹣2800kJ/mol
离子 2Cl-﹣2e-=Cl2↑ Cl2+2NaOH=NaCl+NaClO+H2O C6H12O6 (s)+6O2(g)=6 CO2(g)+6H2O(l) △H=﹣2800kJ/mol
【解析】试题分析:W的单质是淡黄色固体,W是S元素;在同周期中,Z的金属性最强,Q的非金属性最强,Z是Na、Q是Cl;根据X、Y、W在周期表中的相对位置关系,X、Y分别是C、O;
解析:根据以上分析,(1)五种元素形成的单质,其中固态时属于原子晶体的是C;非金属越性强常,氧化性越强,用作强氧化剂的是O2 、Cl2。
(2)电子层数越多半径越大,同周期元素从左到右半径减小,这五种元素中,原子半径最大的是Na;由Z、W、Q形成的简单离子半径由大到小的顺序是S2﹣>Cl﹣>Na+;非金属性越强最高价氧化物的水化物酸性越强,X、W、Q的最高价氧化物的水化物酸性从强到弱的顺序是HClO4>H2SO4>H2CO3。
(3)Y和Z形成的一种化合物中含有离子键和共价键的化合物是过氧化钠,用电子书表示该化合物中化学键的形成过程![]() 。
。
(4)活泼金属与活泼非金属元素形成的化合物为离子化合物,Na与Cl反应生成的化合物氯化钠属于离子化合物;电解氯化钠的饱和溶液,阳极生成氯气,阳极的电极反应式为2Cl-﹣2e-=Cl2↑;阴极生成氢气和氢氧化钠溶液,电解一段时间后,将阳极产物和阴极溶液混合,反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O。
(5)由X、Y和氢三种元素组成的化合物X6H12Y6是葡萄糖C6H12O6, 9 g该化合物燃烧放出140 kJ的热,则1mol C6H12O6燃烧放热2800kJ,该化合物燃烧热的热化学方程式C6H12O6 (s)+6O2(g)=6 CO2(g)+6H2O(l) △H=﹣2800kJ/mol。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】钒是一种熔点很高的金属,具有良好的可塑性和低温抗腐蚀性,有延展性、硬度大,无磁性。广泛应用于钢铁、航空航天、能源、化工等领域。中铝集团 (平果铝业公司)目前使用一种新型工艺,以便从铝业生成的固体废料——赤泥中提取金属钒,具体工艺流程图如下:
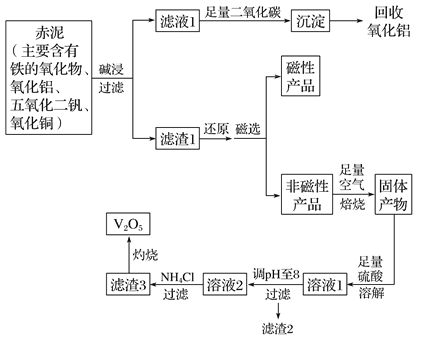
已知:
I.钒有多种价态,其中+5价最稳定。钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡
VO2++H2O![]() VO3-+2H+。
VO3-+2H+。
Ⅱ.部分含钒物质在水中的溶解性如下表所示:
物质 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 易溶 |
Ⅲ.部分离子的沉淀pH值:
Cu2+ | Fe2+ | Fe3+ | |
开始沉淀pH值 | 5.2 | 7.6 | 2.7 |
完全沉淀pH值 | 6.4 | 9.6 | 3.7 |
请回答下列问题:
(1)碱浸步骤中最好选用 。
A.NaOH溶液 B.氨水 C.纯碱溶液
(2)写出滤液1与足量二氧化碳反应的离子方程式 。
(3)磁选步骤得到的磁性产品为 。
(4)溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铜离子,二是使 。
(5)滤渣3的主要成分为 ,工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式 。
【题目】钒是一种熔点很高的金属,具有良好的可塑性和低温抗腐蚀性,有延展性、硬度大,无磁性。广泛应用于钢铁、航空航天、能源、化工等领域。中铝集团 (平果铝业公司)目前使用一种新型工艺,以便从铝业生成的固体废料——赤泥中提取金属钒,具体工艺流程图如下:
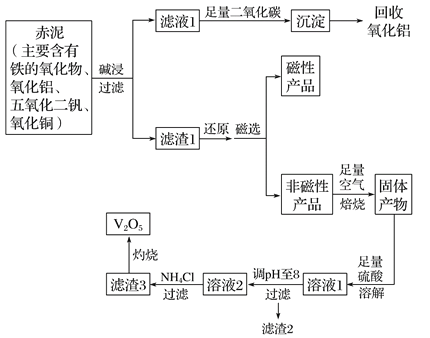
已知:
I.钒有多种价态,其中+5价最稳定。钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡
VO2++H2O![]() VO3-+2H+。
VO3-+2H+。
Ⅱ.部分含钒物质在水中的溶解性如下表所示:
物质 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 易溶 |
Ⅲ.部分离子的沉淀pH值:
Cu2+ | Fe2+ | Fe3+ | |
开始沉淀pH值 | 5.2 | 7.6 | 2.7 |
完全沉淀pH值 | 6.4 | 9.6 | 3.7 |
请回答下列问题:
(1)碱浸步骤中最好选用 。
A.NaOH溶液 B.氨水 C.纯碱溶液
(2)写出滤液1与足量二氧化碳反应的离子方程式 。
(3)磁选步骤得到的磁性产品为 。
(4)溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铜离子,二是使 。
(5)滤渣3的主要成分为 ,工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式 。