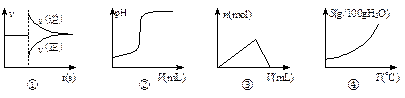题目内容
(7分)把0.6 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:2X(g)+Y(g)=nM(g)+2W(g) 。2 min 末,若测知以W 的浓度变化表示的反应速率为0.05 mol·L-1·min-1,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为5:4,计算:
(1)前2 min内用Y的浓度变化表示的平均反应速率。
(2)2 min末时X的浓度。
(3)化学反应方程式中n的值是多少?
(1)前2 min内用Y的浓度变化表示的平均反应速率。
(2)2 min末时X的浓度。
(3)化学反应方程式中n的值是多少?
(1)0.025 mol·L-1·min-1(1分) (2)0.20 mol·L-1 (1分)
(3)n=4(2分)(合理的步骤2分)
(3)n=4(2分)(合理的步骤2分)
略

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 N2O4的反应)
N2O4的反应) N2O4(g);△H<0,在一定条件下,反应达到平衡后,改变下列条件,再次达到平衡后,容器中气体颜色加深的是( )
N2O4(g);△H<0,在一定条件下,反应达到平衡后,改变下列条件,再次达到平衡后,容器中气体颜色加深的是( ) 2C(g),2S后测得反应速率如下V (A2)=0.4mol/(L·s),V (B2)="1.2" mol/(L·s) ,V (C)= 0.8mol/(L·s) 则该x和y的值分别为
2C(g),2S后测得反应速率如下V (A2)=0.4mol/(L·s),V (B2)="1.2" mol/(L·s) ,V (C)= 0.8mol/(L·s) 则该x和y的值分别为 C(气)+D(气),以下能说明已达平衡状态的是
C(气)+D(气),以下能说明已达平衡状态的是