题目内容
X、Y、Z、W、T是原子序数依次增大的前四个周期的元素,其中有两种是金属元素。其相关信息如下表:
| 元素 | 相关信息 |
| X | X一种核素在考古时常用来坚定一些文物的年代 |
| Y | Y基态原子的s轨道电子与P轨道电子数相等 |
| Z | Z是所在周期的单核离子中半径最小 |
| W | W的单质被誉为“信息革命的催化剂”常用做半导体材料 |
| T | T有多种化合物,其白色氢氧化物在空气中会迅速变为灰绿色,最后变为红褐色 |
(1)X、Y、Z三种元素的电负性由大到小的顺序是________(用元素符号表示,下同);在H-X、H-Y两种共价键中,键的极性较大的是 。
(2)T2+的电子排布式为_________;T的单质在高温下与Y的氢化物反应,其化学方程式为 ;工业上用W的氧化物与X的单质高温下反应制得W单质的粗产品,其化学反应方程式为
(3)两种氢化物X2H2和H2Y2沸点相差很大,其沸点较高的是_______________,两者沸点相差很大的原因是____________________________________。
(4)在25℃、101 kPa下,已知W稳定的气态氢化物在Y的气态单质中完全燃烧,恢复至原来状态,平均每消耗4gW稳定的气态氢化物放热190.0KJ,则该反应的热化学方程式为 _____________。
(1)O>C>Al H—O
(2)[Ar]3d6 3Fe+4H2O(g) Fe3O4+4H2 SiO2 + 2C
Fe3O4+4H2 SiO2 + 2C  Si + 2CO↑
Si + 2CO↑
(3)H2O2 H2O2分子间存在氢键
(4)SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)H=1520.0KJ/mol.
解析试题分析:(1)根据题目提供的信息可推知:X是C;Y是O;Z是Al;W是Si;T是Fe。元素的原子半径越小,元素的非金属性越强,其电负性就越大。在Al、C、O三种元素中非金属性强弱顺序为O>C>Al。所以电负性O>C>Al。元素的非金属性越强,其与H形成的共价键的极性就越强。因此在C—H和H—O键中极性强的是H—O。(2)26号元素Fe失去2个电子后此外层变为最外层。电子排布式为1s22s22p63s23p63d6.或写为[Ar]3d6。高温下Fe与水蒸气反应的方程式为3Fe+4H2O(g) Fe3O4+4H2。在工业上用SiO2于焦炭制取Si的方程式为SiO2 + 2C
Fe3O4+4H2。在工业上用SiO2于焦炭制取Si的方程式为SiO2 + 2C  Si + 2CO↑。(3)C2H2、H2O2都是由分子晶体构成的物质。前者是非极性分子,后者是极性分子。由于H2O2的分子间除了存在一般的分子间作用力外,还存在着氢键,增加了分子之间的相互作用。克服这种分子间作用力使物质熔化或气化消耗的能量就更大,所以沸点H2O2比C2H2高。(4)根据题意可写成该反应的热化学方程式为SiH4(g)+ 2O2(g)=SiO2(s)+2H2O(l)H=1520.0KJ/mol.。
Si + 2CO↑。(3)C2H2、H2O2都是由分子晶体构成的物质。前者是非极性分子,后者是极性分子。由于H2O2的分子间除了存在一般的分子间作用力外,还存在着氢键,增加了分子之间的相互作用。克服这种分子间作用力使物质熔化或气化消耗的能量就更大,所以沸点H2O2比C2H2高。(4)根据题意可写成该反应的热化学方程式为SiH4(g)+ 2O2(g)=SiO2(s)+2H2O(l)H=1520.0KJ/mol.。
考点:考查元素的推断、共价键、电负性的比较、原子的电子排布式的书写、化学方程式、热化学方程式的书写的知识。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案原子序数小于36的四种元素X、Y、Z、W,有关它们的信息如下表所示:
| 元素 | 部分结构知识 | 部分性质 |
| X | X原子核外电子排布在三个能级上,且有三个电子能量相同 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的最外层电子数等于次外层电子数的2倍 | Y是形成化合物种类最多的元素 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W的一种核素质量数为52,中子数为28 | +6价W的化合物有强氧化性,可用于皮革加工、吹气法检查司机是否酒驾等 |
请填写下列空白(答题时X、Y、Z、W用相应的元素符号):
(1)X单质分子的电子式是________,σ键和π键的个数比是________。
(2)Z元素原子最外层共有________种不同运动状态的电子。Z的氢化物液态时________(填“能”或“不能”)导电。
(3)W的基态原子核外电子排布式是_____________________________。
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。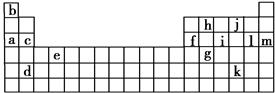
(1)下列________(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。
核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
A.原子核对核外电子的吸引力
B.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
| | 锂 | X | Y |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7 296 | 4 570 | 1 820 |
| 失去第三个电子 | 11 799 | 6 920 | 2 750 |
| 失去第四个电子 | —— | 9 550 | 11 600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量__________________________________。
②表中X可能为以上13种元素中的(填写字母)____________元素。用元素符号表示X和j形成化合物的化学式________________。
③Y是元素周期表中第________族元素。
④以上13种元素中,________(填写字母)元素原子失去核外第一个电子需
要的能量最多。
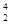 He、
He、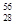 Ni、
Ni、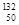 Sn、Pb等尤为稳定。根据此信息回答下列问题:
Sn、Pb等尤为稳定。根据此信息回答下列问题: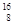 O、
O、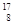 O、
O、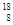 O,根据上述“幻数”规律,氧的同位素中原子核最稳定的是________。
O,根据上述“幻数”规律,氧的同位素中原子核最稳定的是________。 R位于元素周期表的第________周期第________族,核稳定性
R位于元素周期表的第________周期第________族,核稳定性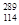 R(填“>”、“<”或“=”)。
R(填“>”、“<”或“=”)。