题目内容
向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图一所示.图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t3~t4阶段使用了催化剂;图一中t~t1阶段c(B)未画出.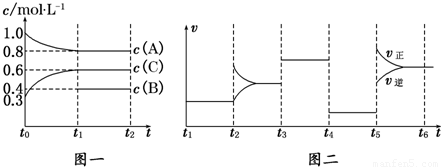
(1)若t1=15min,则t~t1阶段以C浓度变化表示的反应速率为v(C)=______.
(2)t4~t5阶段改变的条件为______,B的起始物质的量为______.
(3)判断图一中可逆反应达到平衡状态的依据是(填序号)______.
①2v正(A)=3v逆(C)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④A、B、C的浓度都不再发生变化
(4)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:______.
(5)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,a、b、c要满足的条件为______.
【答案】分析:本题以图象的形式考查影响化学反应速率以及化学平衡移动的因素.
图二是在四种不同情况下影响化学的平衡,而影响平衡的因素有:浓度、温度、压强、催化剂,
t3~t4和t4~t5这两段平衡是不移动的,则只能是压强和催化剂影响的,因此应该推断该反应为等体积变化的反应.
再结合图一可知,A的变化为0.2mol/L,C的变化量为0.3mol/L,
由规律知,化学反应的速率之比等于化学方程式前的计量系数比,
可写出该反应的方程式为2A(g)+B(g) 3C(g),
3C(g),
t3~t4的平衡比原平衡的速率要快,而t4~t5的速率又变慢,则前者应是加催化剂,后者为减压,因为条件只能用一次;
B的平衡浓度是0.4mol/L,则起始时应为0.5mol/L.
起始2molA所对应的浓度为1mol/L,则体积应是2L.
所以B的起始物质的量为0.5mol/L×2L=1mol;
根据平衡状态的标志和特征判断反应是否达到平衡状态;
(5)考查的是等效平衡.要最终为相同平衡,则必须折算后与原平衡相等.
解答:解:(1)v=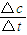 =
= =0.02 mol/(L?min),故答案为:0.02 mol/(L?min);
=0.02 mol/(L?min),故答案为:0.02 mol/(L?min);
(2)结合图一可知,A的变化为0.2mol/L,C的变化量为0.3mol/L,化学反应的速率之比等于化学方程式前的计量系数比,
可写出该反应的方程式为2A(g)+B(g) 3C(g),压强减小,正逆反应速率减小,应反应前后气体的化学计量数之和相等,则改变压强平衡不移动,所以t4~t5阶段改变的条件为减小压强,
3C(g),压强减小,正逆反应速率减小,应反应前后气体的化学计量数之和相等,则改变压强平衡不移动,所以t4~t5阶段改变的条件为减小压强,
B的平衡浓度是0.4mol/L,根据方程式可知,浓度的改变值与化学计量数呈正比,C改变0.3mol/L,则B改变0.1mol/L,
所以起始时应为0.5mol/L,起始2molA所对应的浓度为1mol/L,则体积应是2L,
所以B的起始物质的量为0.5mol/L×2L=1mol,
故答案为:减小压强; 1.0 mol;
(3)①反应达平衡状态时,正逆反应速率相等,则有3v正(A)=2v逆(C),故①错误;
②因气体的质量不变,容器的体积不变,则反应无论是否达到平衡状态,密度都不变,不能作为判断是否达到平衡的依据,故②错误;
③反应前后气体的物质的量不变,质量不变,混合气体的平均相对分子质量不变,不能作为判断是否达到平衡的依据,故③错误;
④当达到平衡状态时,A、B、C的浓度都不再发生变化,可作为平衡状态的判断依据,故④正确,
故答案为:④;
(4)根据方程式计算,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,则反应2molA时,交换热量200akJ,而由图象可知,t5~t6阶段应为升高温度,正反应速率大于逆反应速率,平衡向正反应方向移动,则正反应为吸热反应,所以热化学方程式为2A(g)+B(g) 3C(g)△H=+200a kJ/mol,
3C(g)△H=+200a kJ/mol,
故答案为:2A(g)+B(g) 3C(g)△H=+200a kJ/mol;
3C(g)△H=+200a kJ/mol;
(5)反应的方程式为2A(g)+B(g) 3C(g),
3C(g),
根据方程式计算,起始时,将C从理论上转化为A、B,
则A的物质的量为2mol+ ×0.6mol=2.4mol,B的物质的量为1mol+
×0.6mol=2.4mol,B的物质的量为1mol+ ×0.6mol=1.2mol,
×0.6mol=1.2mol,
在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,则所加物质的物质的量必须折算后与原平衡相等.
所以有a+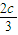 =2.4,b+
=2.4,b+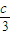 =1.2,
=1.2,
故答案为:a+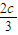 =2.4,b+
=2.4,b+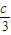 =1.2.
=1.2.
点评:本题以图象的形式考查影响化学反应速率以及化学平衡移动的因素,题目难度中等,注意等效平衡问题,为本题的难点,也是易错点.
图二是在四种不同情况下影响化学的平衡,而影响平衡的因素有:浓度、温度、压强、催化剂,
t3~t4和t4~t5这两段平衡是不移动的,则只能是压强和催化剂影响的,因此应该推断该反应为等体积变化的反应.
再结合图一可知,A的变化为0.2mol/L,C的变化量为0.3mol/L,
由规律知,化学反应的速率之比等于化学方程式前的计量系数比,
可写出该反应的方程式为2A(g)+B(g)
 3C(g),
3C(g),t3~t4的平衡比原平衡的速率要快,而t4~t5的速率又变慢,则前者应是加催化剂,后者为减压,因为条件只能用一次;
B的平衡浓度是0.4mol/L,则起始时应为0.5mol/L.
起始2molA所对应的浓度为1mol/L,则体积应是2L.
所以B的起始物质的量为0.5mol/L×2L=1mol;
根据平衡状态的标志和特征判断反应是否达到平衡状态;
(5)考查的是等效平衡.要最终为相同平衡,则必须折算后与原平衡相等.
解答:解:(1)v=
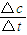 =
= =0.02 mol/(L?min),故答案为:0.02 mol/(L?min);
=0.02 mol/(L?min),故答案为:0.02 mol/(L?min);(2)结合图一可知,A的变化为0.2mol/L,C的变化量为0.3mol/L,化学反应的速率之比等于化学方程式前的计量系数比,
可写出该反应的方程式为2A(g)+B(g)
 3C(g),压强减小,正逆反应速率减小,应反应前后气体的化学计量数之和相等,则改变压强平衡不移动,所以t4~t5阶段改变的条件为减小压强,
3C(g),压强减小,正逆反应速率减小,应反应前后气体的化学计量数之和相等,则改变压强平衡不移动,所以t4~t5阶段改变的条件为减小压强,B的平衡浓度是0.4mol/L,根据方程式可知,浓度的改变值与化学计量数呈正比,C改变0.3mol/L,则B改变0.1mol/L,
所以起始时应为0.5mol/L,起始2molA所对应的浓度为1mol/L,则体积应是2L,
所以B的起始物质的量为0.5mol/L×2L=1mol,
故答案为:减小压强; 1.0 mol;
(3)①反应达平衡状态时,正逆反应速率相等,则有3v正(A)=2v逆(C),故①错误;
②因气体的质量不变,容器的体积不变,则反应无论是否达到平衡状态,密度都不变,不能作为判断是否达到平衡的依据,故②错误;
③反应前后气体的物质的量不变,质量不变,混合气体的平均相对分子质量不变,不能作为判断是否达到平衡的依据,故③错误;
④当达到平衡状态时,A、B、C的浓度都不再发生变化,可作为平衡状态的判断依据,故④正确,
故答案为:④;
(4)根据方程式计算,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,则反应2molA时,交换热量200akJ,而由图象可知,t5~t6阶段应为升高温度,正反应速率大于逆反应速率,平衡向正反应方向移动,则正反应为吸热反应,所以热化学方程式为2A(g)+B(g)
 3C(g)△H=+200a kJ/mol,
3C(g)△H=+200a kJ/mol,故答案为:2A(g)+B(g)
 3C(g)△H=+200a kJ/mol;
3C(g)△H=+200a kJ/mol;(5)反应的方程式为2A(g)+B(g)
 3C(g),
3C(g),根据方程式计算,起始时,将C从理论上转化为A、B,
则A的物质的量为2mol+
 ×0.6mol=2.4mol,B的物质的量为1mol+
×0.6mol=2.4mol,B的物质的量为1mol+ ×0.6mol=1.2mol,
×0.6mol=1.2mol,在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,则所加物质的物质的量必须折算后与原平衡相等.
所以有a+
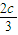 =2.4,b+
=2.4,b+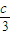 =1.2,
=1.2,故答案为:a+
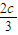 =2.4,b+
=2.4,b+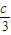 =1.2.
=1.2.点评:本题以图象的形式考查影响化学反应速率以及化学平衡移动的因素,题目难度中等,注意等效平衡问题,为本题的难点,也是易错点.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目

 2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。
2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。 4NH3(g)+3O2(g) △H=Q。
4NH3(g)+3O2(g) △H=Q。 与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
