题目内容
【题目】如图所示向A中充入1 mol X 、1 mol Y,向B中充入2 mol X、2 mol Y,起始时,v(A)=v(B)=a L。在相同温度和有催化剂存在下,两容器中各自发生下述反应:X+Y![]() 2Z+W;(X、Y、Z、W均为气体)正反应为放热反应,达到平衡时,v(A)=1.2a L。
2Z+W;(X、Y、Z、W均为气体)正反应为放热反应,达到平衡时,v(A)=1.2a L。
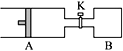
试回答:
(1)A中X的转化率α(A)_______________________________________________________。
(2)A、B中X的转化率的关系:α(A) ___________α(B)。(填“<”“>”或“=”)
(3)打开K,一段时间又达到平衡,A的体积为___________L。(连通管中气体体积不计)
【答案】40% >2.6a
【解析】
(1)A为恒温恒压过程,体积之比等于物质的量之比,据此计算平衡后A中混合气体的物质的量,根据差量法计算参加反应的X的物质的量,根据转化率定义计算;
(2)A为恒温恒压容器,B为恒温恒容容器,反应前后是气体体积增大的反应,A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,B容器与A相比相当于增大了压强;
(3)开K保持温度不变,A、B为等效平衡;
(1)A为恒温恒压过程,达到平衡时V(A)=1.2a L,等压等温条件下,气体的体积之比等于气体的物质的量之比,所以平衡后混合气体的物质的量是2mol×1.2=2.4mol,设参加反应的X的物质的量为x mol,
X + Y![]() 2Z + W
2Z + W ![]()
1 1 2 1 1
X 2.4-2;
![]()
X=0.4mol,所以A中X的转化率α(A)![]() ;
;
(2)A为恒温恒压容器,B为恒温恒容容器,反应前后是气体体积增大的反应,A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,B容器与A相比相当于增大了压强,平衡逆向进行,平衡后A中的X的转化率大,所以α(A) >α(B);
(3)打开K,保持温度不变,A、B为等效平衡,B投料为A的2倍,所以A中平衡后气体的体积为2.4a,则总体积为3.6a,A的体积为3.6a-a=2.6aL;