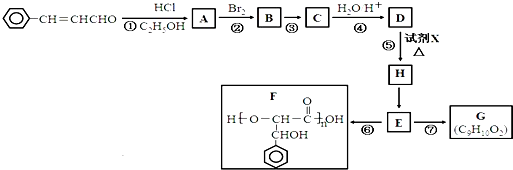
题目内容
称取苯酚试样1.000g加NaOH溶液溶解后,用水稀释至250.0mL.移取25.00mL该溶液于锥形瓶中,加溴液25.00mL(其中只含0.2505g KBrO3及过量KBr)及盐酸,使苯酚溴化为三溴苯酚,再加入过量KI溶液,使未反应的Br2还原并析出I2,然后用0.2000mol?L-1的Na2S2O3标准溶液滴定I2(I2+2Na2S2O3═Na2S4O6+2NaI),用去15.00mL.(KBrO3的相对质量为167,苯酚C6H5OH的相对质量为94)
(1)写出溴液与盐酸反应产生溴的化学反应方程式 .
(2)写出Br2与KI反应的离子方程式 .
(3)计算试样中苯酚的含量(质量百分数).
(1)写出溴液与盐酸反应产生溴的化学反应方程式
(2)写出Br2与KI反应的离子方程式
(3)计算试样中苯酚的含量(质量百分数).
考点:化学方程式的有关计算
专题:计算题
分析:(1)根据溴液中BrO3-和Br-在酸性条件下发生归中反应产生单质和水;
(2)单质溴具有氧化性,能将碘离子氧化生成单质碘;
(3)依据与苯酚反应的溴单质物质的量计算苯酚物质的量得到苯酚质量分数.
(2)单质溴具有氧化性,能将碘离子氧化生成单质碘;
(3)依据与苯酚反应的溴单质物质的量计算苯酚物质的量得到苯酚质量分数.
解答:
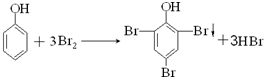
解:(1)溴液中含有的KBrO3及过量KBr在盐酸条件下反应产生单质溴、氯化钾和水,方程式为:KBrO3+5KBr+6HCl═3Br2+6KCl+3H2O,
故答案为:KBrO3+5KBr+6HCl═3Br2+6KCl+3H2O;
(2)单质溴具有氧化性,能将碘离子氧化生成单质碘,离子方程式为:Br2+2I-=2Br-+I2,故答案为:Br2+2I-=2Br-+I2;
(3)由反应定量关系可知,
I2 +2Na2S2O3═Na2S4O6+2NaI
1 2
1.5×10-3moL 0.2000mol?L-1×15×10-3L
Br2+2I-=2Br-+I2
1 1
1.5×10-3moL 1.5×10-3moL
未反应的Br2为1.5×10-3moL,
KBrO3+5KBr+6HCl═3Br2+6KCl+3H2O
1 3
4.5×10-3moL
则与苯酚溴化为三溴苯酚的单质溴为4.5×10-3moL-1.5×10-3moL=3×10-3moL,
 ,
,
1 3
1×10-3moL 3×10-3moL,
25.00mL中苯酚物质的量1×10-3moL,250ml溶液中苯酚物质的量为1×10-2moL,苯酚的纯度
×100%=94%;
答:试样中苯酚的含量94%.
故答案为:KBrO3+5KBr+6HCl═3Br2+6KCl+3H2O;
(2)单质溴具有氧化性,能将碘离子氧化生成单质碘,离子方程式为:Br2+2I-=2Br-+I2,故答案为:Br2+2I-=2Br-+I2;
(3)由反应定量关系可知,
I2 +2Na2S2O3═Na2S4O6+2NaI
1 2
1.5×10-3moL 0.2000mol?L-1×15×10-3L
Br2+2I-=2Br-+I2
1 1
1.5×10-3moL 1.5×10-3moL
未反应的Br2为1.5×10-3moL,
KBrO3+5KBr+6HCl═3Br2+6KCl+3H2O
1 3
| 0.2505g |
| 167g/mol |
则与苯酚溴化为三溴苯酚的单质溴为4.5×10-3moL-1.5×10-3moL=3×10-3moL,
 ,
,1 3
1×10-3moL 3×10-3moL,
25.00mL中苯酚物质的量1×10-3moL,250ml溶液中苯酚物质的量为1×10-2moL,苯酚的纯度
| 1×10-2moL×94g/mol |
| 1.000g |
答:试样中苯酚的含量94%.
点评:本题考查了实验探究氧化还原反应的定量计算和实验过程分析判断,滴定实验的过程分析应用,注意题干实验步骤的分析是解题关键,题目难度中等.

练习册系列答案
相关题目
已知葡萄糖(C6H12O6)的燃烧热是2804kJ?mol-1,当它被氧化生成1mol水时放出的热量是( )
| A、26.0kJ |
| B、51.9kJ |
| C、155.8kJ |
| D、467.3kJ |
下列各溶液中NO3-物质的量浓度最大的是( )
| A、20mL 2mol/L Mg(NO3)2 |
| B、100mL 2.5mol/L NaNO3 |
| C、25mL 1.0mol/L Al(NO3)3 |
| D、30mL 2.5mol/L NH4NO3 |
不久前报道湖南生产的一批大米镉含量超标,原因是灌溉弄跳的湘江水受到了上游化工厂污水的污染,镉是重金属之一,对人体有害.现有新型处理剂Na2FeO4有强氧化性,能将镉氧化回收,以降低水的污染.Na2FeO4可用FeSO4与Na2O2来制备,反应为:FeSO4+2Na2O2═Na2FeO4+Na2SO4下列说法错误的是( )
| A、Na2FeO4只是氧化产物 |
| B、Na2O2具有杀菌消毒作用 |
| C、1mol FeSO4发生反应时,共有4mol电子转移 |
| D、Na2FeO4处理水时除有杀菌作用外其生成物还有净水作用 |
下列说法正确的是( )
| A、H、D、T表示三种氢原子 |
| B、原子最外层少于4个电子的元素均是金属元素 |
| C、稀有气体元素最外层电子数均为8个 |
| D、目前人们已发现了5000多种核素,说明发现了5000多种元素 |