题目内容
【题目】下表是元素周期表的一部分,列出11种元素在周期表中的位置,填写下列空白。

(1)第三周期元素中,原子半径最大的元素是(稀有气体除外)______,离子半径最小的是____(写元素符号)。
(2)J的简单离子的结构示意图__________。
(3)D、E、F、K四元素的最高价氧化物对应水化物,按碱性依次减弱顺序排列为(写化学式)____。
(4)比较G、H两元素的最高价氧化物对应水化物的酸性______(写化学式,下同)。比较C、G两元素的气态氢化物稳定性_________。
【答案】 Na Al  KOH>NaOH>Mg(OH)2>Al(OH)3 HClO4>H2SO4 H2O>H2S
KOH>NaOH>Mg(OH)2>Al(OH)3 HClO4>H2SO4 H2O>H2S
【解析】由元素在周期表中位置,可知A为氢,B为碳,C为氧,D为Na,E为Mg,F为Al,G为硫,H为Cl,I为Ar,K为钾,J为Ca。
(1)同周期自左而右原子半径减小,故第三周期中Na原子半径最大;电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,离子半径最小为Al3+;故答案为:Na;Al;
(2)J的简单离子为Ca2+,离子核外电子数为18,离子结构示意图为: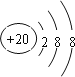 ,故答案为:
,故答案为: ;
;
(3)同周期自左而右金属性减弱,同主族自上而下金属性增强,金属性越强,最高价氧化物对应水化物的碱性越强,按碱性依次减弱顺序排列为:KOH>NaOH>Mg(OH)2>Al(OH)3,故答案为:KOH>NaOH>Mg(OH)2>Al(OH)3;
(4)非金属性Cl>S,故酸性HClO4>H2SO4,非金属性O>S,氢化物稳定性:H2O>H2S,答案为:HClO4>H2SO4;H2O>H2S。

【题目】煤化工中常需研究不同温度下平衡常数、投料比等问题。
已知:CO(g)+H2O(g)![]() H2(g)+CO2(g)平衡常数K随温度的变化如下表:
H2(g)+CO2(g)平衡常数K随温度的变化如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
回答下列问题
(1)该反应的平衡常数表达式K= ,△H 0(填“<”、“>”、“=”)
(2)已知在一定温度下,C(s)+CO2(g)![]() 2CO(g)平衡常数K1
2CO(g)平衡常数K1
C(s)+H2O(g)![]() H2(g)+CO(g)平衡常数K2,
H2(g)+CO(g)平衡常数K2,
则K、K1、K2,之间的关系是 。
(3)800℃时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时 间后反应达到平衡,此时CO的转化率为 ;若保持其他条件不变,向平衡体系中再通入0.10molCO和0.40mol CO2,此时v正 v逆 (填“>”、“=”或“<”).