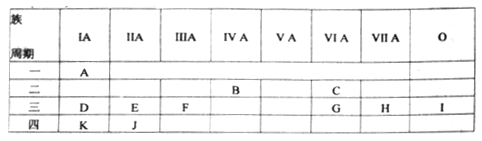
题目内容
【题目】煤化工中常需研究不同温度下平衡常数、投料比等问题。
已知:CO(g)+H2O(g)![]() H2(g)+CO2(g)平衡常数K随温度的变化如下表:
H2(g)+CO2(g)平衡常数K随温度的变化如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
回答下列问题
(1)该反应的平衡常数表达式K= ,△H 0(填“<”、“>”、“=”)
(2)已知在一定温度下,C(s)+CO2(g)![]() 2CO(g)平衡常数K1
2CO(g)平衡常数K1
C(s)+H2O(g)![]() H2(g)+CO(g)平衡常数K2,
H2(g)+CO(g)平衡常数K2,
则K、K1、K2,之间的关系是 。
(3)800℃时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时 间后反应达到平衡,此时CO的转化率为 ;若保持其他条件不变,向平衡体系中再通入0.10molCO和0.40mol CO2,此时v正 v逆 (填“>”、“=”或“<”).
【答案】(1)K =![]() < (2)K=
< (2)K= ![]() (3) 80% =
(3) 80% =
【解析】
试题分析:(1)根据化学方程式可知,该反应的平衡常数表达式为K =![]() ;由于随着温度的升高,由于随着温度的升高,平衡常数减小,说明平衡逆向移动,因此该反应是放热反应,△H<0;
;由于随着温度的升高,由于随着温度的升高,平衡常数减小,说明平衡逆向移动,因此该反应是放热反应,△H<0;
(2)CO(g)+H2O(g)![]() H2(g)+CO2(g) K①;
H2(g)+CO2(g) K①;
C(s)+CO2(g)![]() 2CO(g) K1②;
2CO(g) K1②;
C(s)+H2O(g)![]() H2(g)+CO(g) K2③;
H2(g)+CO(g) K2③;
由于三个方程式的关系是:①=③-②,根据盖斯定律可知,K=![]() ;
;
(3)由题意可知,当温度为800℃时,CO与水蒸气反应的平衡常数K=1,据此进行计算:
CO(g)+H2O(g)![]() H2(g)+CO2(g)
H2(g)+CO2(g)
起始浓度(mol/L) 0.04 0.16 0 0
转化浓度(mol/L) x x x x
平衡浓度(mol/L) 0.04-x 0.16-x x x
K=![]() =1
=1
解得:x=0.032 mol/L,即CO转化了0.32mol,CO的转化率为:0.32/0.4=80%;
平衡时,各物质的浓度分别为:
CO(g)+H2O(g)![]() H2(g)+CO2(g)
H2(g)+CO2(g)
0.008 0.128 0.032 0.032
若保持其他条件不变,向平衡体系中再通入0.10molCO和0.40mol CO2,通入的瞬间,各物质的浓度为:
CO(g)+H2O(g)![]() H2(g)+CO2(g)
H2(g)+CO2(g)
0.018 0.128 0.032 0.072
浓度熵Q=![]() =1=K,因此平衡不移动,故v正=v逆。
=1=K,因此平衡不移动,故v正=v逆。