题目内容
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、量筒、0.5 mol![]() 盐酸、0.55 mol
盐酸、0.55 mol![]() NaOH溶液,实验尚缺少的玻璃用品是________________。
NaOH溶液,实验尚缺少的玻璃用品是________________。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?_____________(填“能”或“否”)
(3)他们记录的实验数据如下:

已知:Q=cm(t2﹣t1),反应后溶液的比热容c为4.18 J℃﹣1g﹣1,
各物质的密度均为1 gcm﹣3。
①计算完成上表ΔH=_____________________________(保留2位小数)。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:__。
(4)若用醋酸代替HCl做实验,对测定结果___填“有”或“无”)影响。
【答案】温度计 否 -56.85 HCl(aq)+NaOH(aq)====NaCl(aq)+H2O(l)ΔH=-56.8 kJ![]() 有
有
【解析】
测定中和热实验中,实验设备有烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、量筒、温度计,其中泡沫塑料保温,实验整体需减少热量的散失,尽量做到绝热;中和热要求是酸与碱中和反应产生1mol水所放出的热量,弱电解质电离吸热,势必影响实验结果。
(1)中和反应实验设备包括烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、量筒、温度计,故实验尚缺少的玻璃用品是温度计;
(2)金属铜丝是热的良导体,用它搅拌能增大热量的散失,故不能代替环形玻璃搅拌棒;
(3) ①第一次实验反应前后温度差为3.3℃,第2次实验反应前后温度差为3.5℃,平均温差为3.4℃,50mL0.55mol/L的氢氧化钠溶液与50mL0.5mol/L的盐酸发生中和反应,质量和为m=100mL×1 g/cm﹣3=100g,c=4.18 J℃﹣1g﹣1,代入公式Q=cm(t2﹣t1)得生成0.025mol的水放出的热量Q= 4.18 J℃﹣1g﹣1×100g×3.4℃=1421.2J,所以生成1mol水放出的热量为1421.2J×40=56.85kJ,ΔH=-56.85kJ;
②反应的热化学方程式:HCl(aq)+NaOH(aq)====NaCl(aq)+H2O(l)ΔH=-56.8 kJmol-1;
(4)若用醋酸代替HCl做实验,醋酸为弱电解质,与碱发生中和反应时,电离出氢离子吸收热量,故反应整体放出热量小于56.85kJ,对测定结果有影响。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案【题目】中华民族历史悠久,在浩瀚的历史文明中有许多关于化学的记载,下列说法不合理的是( )
选项 | 古代文献 | 记载内容 | 涉及原理 |
A | 《淮南万毕术》 | “曾青得铁则化为铜” | 活泼金属置换不活泼金属 |
B | 《鹤林玉露·一钱斩吏》 | “一日一钱,千日千钱,绳锯木断,水滴石穿” | 不涉及化学变化 |
C | 《天工开物》 | “凡火药,硫为纯阳,硝为纯阴” | 纯阴指化合价降低,利用硝酸钾的氧化性 |
D | 《肘后备急方》 | “青蒿一握,以水二升渍,绞取汁” | 利用物理方法提取青蒿素 |
A. AB. BC. CD. D
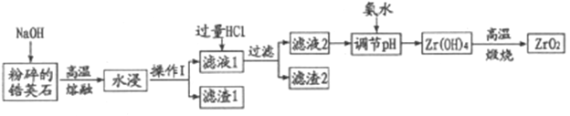
【题目】氧化材料具有高硬度、高强度、高韧性、极高的耐磨性及耐化学腐蚀性等优良的物化性能。以锆英石(主要成分为 ZrSiO4,含有少量Al2O3、SiO2、Fe2O3等杂质)为原料通过碱熔法制备氧化锆(ZrO2)的流程如下:
25℃时,有关离子在水溶液中沉淀时的pH数据:
Fe(OH)3 | Zr(OH)4 | Al(OH)3 | |
开始沉淀时pH | 1.9 | 2.2 | 3.4 |
沉淀完全时pH | 3.2 | 3.2 | 4.7 |
请回答下列问题:
(1)流程中旨在提高化学反应速率的措施有___________。
(2)操作I的名称是___________滤渣2的成分为___________。
(3)锆英石经“高温熔融”转化为Na2ZrO3,写出该反应的化学方程式:___________。
(4)“调节pH”时,合适的pH范围是___________。为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是___________。
(5)写出“高温煅烧”过程的化学方程式___________。根据ZrO2的性质,推测其两种用途___________。
【题目】(1)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
热化学方程式 | 平衡常数 | |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
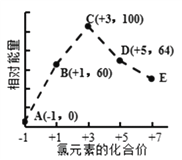
则该温度下,ΔH3=_______________kJmol-1;K3=_____________(用K1和K2表示)。
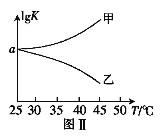
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则ΔH3 ___(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是_____________;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是______(填“甲”或“乙”),a值为__________。25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,则此时v正_________v逆(填“>”“<”或“=”)

(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。