题目内容
在溶液中加入过量Na2O2后仍能大量共存的离子组是
| A.NH+4、Ba2+、Cl-、NO3- | B.K+、AlO-2、Cl-、SO42- |
| C.Ca2+、Mg2+、NO3-、HCO3- | D.Na+、Cl-、CO32-、SO32- |
B
解析试题分析:Na2O2具有强氧化性,加入Na2O2后溶液中存在OH-。A、NH4+与OH-结合生成一水合氨弱碱,不能大量共存,错误;B、彼此都不反应,能大量共存,正确;C、Ca2+、Mg2+、HCO3-与OH-结合生成沉淀,不能大量共存,错误;D、Na2O2具有强氧化性,可以氧化SO32-为SO42-不能大量共存,错误,答案选B。
考点:考查离子反应的大量共存问题

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
下列解释事实的离子方程式不正确的是
A.氯化铜溶液显酸性:Cu2++2H2O Cu(OH)2+2H+ Cu(OH)2+2H+ |
| B.氯气使湿润的淀粉KI试纸变蓝:Cl2+2I-="2" Cl-+I2 |
| C.向硫酸铝溶液中加入氨水出现白色胶状沉淀:Al3++3OH-=Al(OH)3↓ |
| D.实验室不用玻璃塞试剂瓶盛装氢氧化钠溶液:SiO2+2 OH-= SiO32-+H2O |
下列离子方程式不正确的是 ( )
A.溴乙烷在氢氧化钠水溶液中的反应:CH3CH2Br + OH-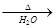 CH3CH2OH +Br- CH3CH2OH +Br- |
B.醋酸溶液与氢氧化铜反应:2CH3COOH + Cu(OH)2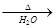 Cu2+ + 2CH3COO-+ 2H2O Cu2+ + 2CH3COO-+ 2H2O |
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+ CO2 + H2O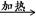 2C6H5OH + CO32- 2C6H5OH + CO32- |
D.甲醛溶液与足量的银氨溶液共热HCHO+4[Ag(NH3)2]++4OH-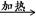 CO32-+2NH4+ +4Ag↓+6NH3+2H2O CO32-+2NH4+ +4Ag↓+6NH3+2H2O |
下列物质中,属于电解质的是
| A.蔗糖 | B.金属铜 | C.氢氧化钠溶液 | D.氯化钠 |
下列事实、离子方程式及其对应关系均正确的是:
| A.铁溶于稀硝酸,溶液变为浅绿色:Fe + 4H+ + NO3—= Fe3+ + NO ↑ + 2H2O |
B.向K2Cr2O7溶液中滴加少量浓H2SO4,溶液变为黄色: Cr2O72-(橙色) + H2O  2CrO42-(黄色) +2H+ 2CrO42-(黄色) +2H+ |
| C.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H+ + 4I- + O2 =2I2 + 2H2O |
D.向水杨酸(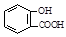 )中滴加NaHCO3溶液,放出无色气体: )中滴加NaHCO3溶液,放出无色气体: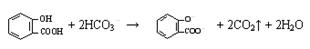 |
下列解释物质用途或现象的反应方程式不准确的是
A.硫酸型酸雨的形成会涉及反应:2H2SO3+O2 2H2SO4 2H2SO4 |
B.热的纯碱溶液可以清洗油污的原因: +2H2O +2H2O H2CO3+2OH¯ H2CO3+2OH¯ |
C.盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH¯=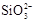 +H2O +H2O |
| D.成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl¯+ ClO¯+2H+= Cl2↑+ H2O |
下列离子方程式的书写及评价均合理的是
| 选项 | 离子方程式 | 评价 |
| A | 将1molCl2通入到含1molFeI2的溶液中: 2Fe2++2I-+2Cl2 =2Fe3++4Cl-+I2 | 正确;Cl2过量,可将 Fe2+ 、I-均氧化 |
| B | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++ HCO3-+ OH-=MgCO3↓+ H2O | 正确;酸式盐与碱反应 生成正盐和水 |
| C | 过量SO2通入到NaClO溶液中: SO2 + H2O + ClO-= HClO+HSO3- | 正确;说明酸性: H2SO3强于HClO |
| D | 1mol/L的Na [Al(OH)4]溶液和2.5mol/L的HCl溶 液等体积互相均匀混合:2[Al(OH)4]-+ 5H+ = Al3+ +Al(OH)3↓+ 5H2O | 正确;[Al(OH)4]-与 Al(OH)3消耗的H+的物 质的量之比为2:3 |
下列有关的离子方程式中正确的是( )
| A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4+ |
B.铜片接电源正极,碳棒接电源负极,电解硫酸溶液:Cu+2H+ Cu2++H2↑ Cu2++H2↑ |
C.磷酸一氢钠溶液水解:HPO42-+H2O PO43-+H3O+ PO43-+H3O+ |
| D.实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O=4Fe3++4OH- |
下列反应的离子方程式书写正确的是( )
| A.将Al条投入NaOH溶液中:Al+OH-+H2O=AlO2—+H2↑ |
| B.铜溶于稀硝酸中:Cu+4H++2NO3—=Cu2++2NO2↑+2H2O |
| C.碳酸氢钙溶液中加入过量的氢氧化钠溶液:HCO3—+OH-=CO32—+H2O |
| D.向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀醋酸:CO32—+CH3COOH=CH3COO-+HCO3— |