题目内容
【题目】铝及其化合物在生活、生产中有广泛应用。
(1)Al与NaOH溶液能够形成原电池,写出该电池的负极反应式________。Al的原子结构示意图为_______。不能电解A1的氯化物来生产Al,原因是________;
(2)Na3AlF6是冰晶石的主要成分,冰晶石常作工业冶炼铝的助熔剂。工业上用HF、Na2CO3和A1(OH)3制备冰晶石。写出制备冰晶石的化学方程式________。上述反应不能在玻璃容器中反应,其原因是__________(用化学方程式表示)。
(3)明矾[KA1(SO4)2·12H2O]常作净水剂。在明矾溶液中滴加氢氧化钡溶液至Al3+恰好完全沉淀,写出该反应的离子方程式_______________。
(4)铝合金广泛用于建筑材料。等质量的铁、铝、硅组成的同种合金分别与足量盐酸、足量烧碱溶液反应,产生气体体积相等(同温同压)。则该合金中铁、硅的质量之比为________(已知:Si+2NaOH+H2O=Na2SiO3+2H2↑)
(5)铝氢化钠(NaAlH4)是有机合成的重要还原剂。它的制备方法是将氢化钠和氯化铝在乙醚中反应制备铝氢化钠。
①写出化学方程式_____________;
②在化学上,含包还原剂的还原能力用“有效氢”表示,“有效氢”含义是单位质量的含氢还原剂的还原能力相当于多少克氢气。一般地含氢还原剂的氢被氧化成H2O,“还原能力”用氢失去电子数多少表示。NaAlH4、NaH的“有效氢”之比为___________。
【答案】 Al+4OH--3e-=AlO2-+2H2O 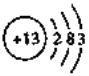 AlCl3为分子晶体,在熔融态时不电离,不能被电解 2Al(OH)3+3Na2CO3+12HF=2Na3AlF6+3CO2↑+9H2O SiO2+4HF=SiF4+2H2O 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ 4:1 AlCl3+4NaH=NaAlH4+3NaCl 16:9
AlCl3为分子晶体,在熔融态时不电离,不能被电解 2Al(OH)3+3Na2CO3+12HF=2Na3AlF6+3CO2↑+9H2O SiO2+4HF=SiF4+2H2O 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ 4:1 AlCl3+4NaH=NaAlH4+3NaCl 16:9
【解析】分析:(1)铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,构成原电池后,负极上铝失去电子生成偏铝酸根离子;Al为13号元素;氯化铝是分子晶体;
(2)Al(OH)3、纯碱、HF在一定条件下生成Na3AlF6、水和二氧化碳;氢氟酸能够与玻璃中的二氧化硅反应;
(3)向明矾水溶液中滴加氢氧化钡溶液使Al3+恰好完全沉淀生成氢氧化铝,1mol明矾需要1.5mol氢氧化钡;
(4)铝和盐酸的反应方程式:2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,说明相同质量的铝与盐酸或者氢氧化钠生成氢气的质量相等,因此铁和盐酸生成的氢气的质量等于硅和氢氧化钠生成的氢气的质量;
(5)②根据有效含氢量的定义,每克含氢还原剂的还原能力相当于多少克H2的还原能力,H2做还原剂,1molH2失去电子2mol,“有效氢”之比为应等于等质量的还原剂失去电子的物质的量之比。
详解:(1)铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,构成原电池后,负极上铝失去电子生成偏铝酸根离子,电极反应式为Al+4OH--3e-=AlO2-+2H2O;Al原子核外电子数为13,有3个电子层,各层电子数为2、8、3,结构示意图为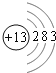 ;氯化铝是分子晶体,熔融状态不能导电,因此不能被电解,故答案为:Al+4OH--3e-=AlO2-+2H2O ;
;氯化铝是分子晶体,熔融状态不能导电,因此不能被电解,故答案为:Al+4OH--3e-=AlO2-+2H2O ; ;AlCl3为分子晶体,在熔融态时不电离,不能被电解;
;AlCl3为分子晶体,在熔融态时不电离,不能被电解;
(2)Al(OH)3、纯碱、HF在一定条件下生成Na3AlF6、水和二氧化碳,方程式为2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O,氢氟酸能够与玻璃中的二氧化硅反应,SiO2+4HF=SiF4+2H2O,因此上述反应不能在玻璃容器中反应,故答案为:2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O;SiO2+4HF=SiF4+2H2O;
(3)向明矾水溶液中滴加氢氧化钡溶液使Al3+恰好完全沉淀的反应为2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓,故答案为:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓;
(4)根据题目信息可知,铁和铝与稀盐酸生成氢气,铝和硅与氢氧化钠生成氢气。铝和盐酸的反应方程式:2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,说明相同质量的铝与盐酸或者氢氧化钠生成氢气的质量相等,因此铁和盐酸生成的氢气的质量等于硅和氢氧化钠生成的氢气的质量。设铁与盐酸生成的氢气的质量为M,硅的质量为X,铁的质量为Y。
Si+2NaOH+H2O═Na2SiO3+2H2↑
28 4
X M
![]() =
=![]() ,得:X=7M;
,得:X=7M;
Fe+2HCl=FeCl2+H2↑
56 2
Y M
![]() =
=![]() ,得:Y=28M,∴合金中铁和硅的质量之比=28M:7M =4:1,故答案为:4:1;
,得:Y=28M,∴合金中铁和硅的质量之比=28M:7M =4:1,故答案为:4:1;
(5)①氢化钠和氯化铝在乙醚中反应制备铝氢化钠,反应的化学方程式为AlCl3+4NaH=NaAlH4+3NaCl,故答案为:AlCl3+4NaH=NaAlH4+3NaCl;
②NaA1H4中H为-1价,做还原剂时,H从-1价升高为+1价,1molNaBH4转移电子数为4×2=8mol,则1gNaA1H4失去电子的物质的量为![]() ×4×2mol=
×4×2mol=![]() mol,
mol,
NaH中H为-1价,做还原剂时,H从-1价升高为+1价,1molNaH转移电子数为2mol,则1gNaH失去电子的物质的量为![]() ×2mol=
×2mol=![]() mol,则NaA1H4,NaH的“有效氢”之比为
mol,则NaA1H4,NaH的“有效氢”之比为![]() mol:
mol:![]() mol=16:9,故答案为:16:9。
mol=16:9,故答案为:16:9。

 名校课堂系列答案
名校课堂系列答案