题目内容
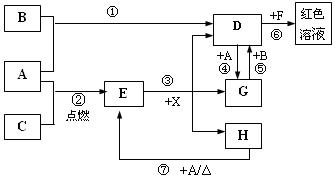
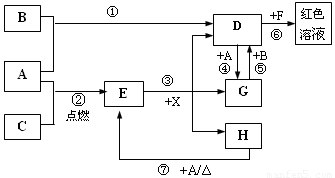
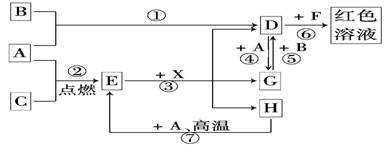
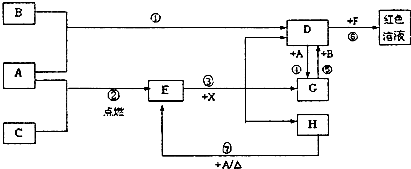
(20分)A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。

(1)写出下列物质的化学式:D X 。
(2)在反应①~⑦中,不属于氧化还原反应的是 (填编号)。
(3)反应⑥的离子方程式为: 。
(4)往G溶液中加入NaOH溶液观察到的现象是 。
(5)反应⑦的化学方程式为 ;该反应中每消耗0.3mol的A,可转移电子 mol。
(6)除去D溶液中混有的少量G的方法是:
(7)在D溶液中制备无水D的方法是:
(8)分别写出D溶液与小苏打溶液反应的离子方程式是:
(1)FeCl3 (1分) HCl(1分) (2)③⑥(1分)
(3)Fe3++3SCN-=Fe(SCN)3;(2分)
(4)生成白色沉淀,迅速变为灰绿色,最终变为红褐色。(2分)
(5)3Fe+4H2O(g) Fe3O4+4H2
(2分) 0.8(1分)
Fe3O4+4H2
(2分) 0.8(1分)
(6)向混合液中通入足量氯气(或加入足量H2O2)
(7)在HCl气流中加热蒸干FeCl3溶液
(8)Fe3++ 3HCO3- = Fe(OH)3 ↓+ 3CO2↑
【解析】本题是无机框图题,关键是找准突破点。B为黄绿色气体,所以B是氯气。根据反应①④可知,A应该是是变价的金属铁,所以D是氯化铁,G是氯化亚铁。X常温下是无色气体,其水溶液是一种无氧强酸溶液,因此X是氯化氢。所以C是氧气,E是四氧化三铁。H在常温下为液体,则H是水。氯化铁和F生成红色溶液,所以F是KSCN。
(1)(3)略(2)四氧化三铁和盐酸以及氯化铁和KSCN溶液的反应都不是氧化还原反应。
(4)氢氧化亚铁不温度极易被氧化生成氢氧化铁,所以现象是生成白色沉淀,迅速变为灰绿色,最终变为红褐色。
(5)高温下铁和水蒸气反应生成四氧化三铁和氢气,方程式为3Fe+4H2O(g) Fe3O4+4H2。四氧化三铁中铁的化合价是+8/3价,所以主要电子是8/3,则每消耗0.3mol的A,可转移电子0.8mol。
Fe3O4+4H2。四氧化三铁中铁的化合价是+8/3价,所以主要电子是8/3,则每消耗0.3mol的A,可转移电子0.8mol。
(6)氯化亚铁具有还原性,所以除去氯化铁中的氯化亚铁的方法是向混合液中通入足量氯气(或加入足量H2O2)。
(7)氯化铁在溶液中存在水解平衡,生成氢氧化铁和氯化氢,因此制备氯化铁必须反之水解,所以在D溶液中制备无水D的方法是在HCl气流中加热蒸干FeCl3溶液。
(8)原因碳酸氢钠水解显碱性,所以能和氯化铁相互促进,方程式为Fe3++ 3HCO3- = Fe(OH)3 ↓+ 3CO2↑。

 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案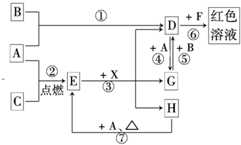 (2012?石景山区一模)A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体.D、E、F、G、H、X、Y均为化合物,其中X是一种无氧强酸、E为黑色晶体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去).
(2012?石景山区一模)A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体.D、E、F、G、H、X、Y均为化合物,其中X是一种无氧强酸、E为黑色晶体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去).
 金属;通常情况下A为
金属;通常情况下A为 固体、B为液体、C为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。
固体、B为液体、C为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。