题目内容
【题目】如图所示,烧杯中的溶液为2 mol·L-1CH3COOH溶液,接通直流电源。分别向烧杯中加入下列物质(保持反应温度不变),灯泡变暗的是( )

A.加入固体NaOHB.加水稀释C.加入金属NaD.通入HCl气体
【答案】B
【解析】
溶液的导电性与溶液中离子的电荷浓度有关,电荷浓度越大,溶液导电性越强,灯泡越亮,
A. CH3COOH是弱电解质,在溶液中部分电离,加入固体NaOH生成醋酸钠,生成强电解质,溶液中离子浓度增大,导电性增强,灯泡变亮,故A不符合题意;
B. 加水稀释,溶液中离子浓度减小,导电性减弱,灯泡变暗,故B符合题意;
C. 加入金属Na,生成醋酸钠,生成强电解质,溶液中离子浓度增大,导电性增强,灯泡变亮,故C不符合题意;
D. 通入HC1气体,HCl为强电解质,溶液中离子浓度增大,导电性增强,灯泡变亮,故D不符合题意;
答案选B。

【题目】高锰酸钾是中学常用化学试剂,工业上常以软锰矿(主要成分是MnO2)为原料进行制备,主要工艺流程如下图:

已知:3K2MnO4+2H3PO4═2KMnO4+MnO2↓+2K2HPO4+2H2O
物质 | KMnO4 | K2HPO4 | K2SO4 | CH3COOK | KCl | K2CO3 |
293K溶解度/g | 6.4 | 150 | 11.1 | 217 | 34 | 111 |
(1)原料高温煅烧时选用铁坩埚和铁棒,理由是__________。
(2)①中每生成1molK2MnO4时电子转移2mol,写出化学反应方程式_________。
(3)从反应机理和产物分离角度考虑,③可用磷酸,也可用下列________试剂。
A.醋酸 B.盐酸 C.硫酸 D.CO2
(4)下列描述不正确的是_________。
A.操作⑤中蒸发至大量晶体析出再冷却晶体,趁热过滤
B.抽滤时布氏漏斗中选用大小略小于漏斗内径且盖住全部小孔的滤纸
C.可用无水乙醇洗涤产品提高纯度
D.KMnO4晶体的烘干温度过高会降低产率
(5)粗产品的洗涤步骤可能需要用到以下操作:a.加入洗涤剂至浸没固体;b.洗涤剂缓慢通过;c.洗涤剂快速通过;d.关小水龙头;e.开大水龙头;f.重复2~3次。
请选出正确的操作并排序________。(操作可重复使用)
(6)高锰酸钾产品的纯度测定:准确称取0.7900g产品,配成250mL溶液,量取25.00mL于锥形瓶中,用0.1000molL﹣1(NH4)2Fe(SO4)2标准溶液进行滴定,滴定终点的现象__________。滴定前和滴定后的液面见下图。计算出高锰酸钾的纯度为_______。

【题目】高锰酸钾是中学常用化学试剂,工业上常以软锰矿(主要成分是MnO2)为原料进行制备,主要工艺流程如下图:
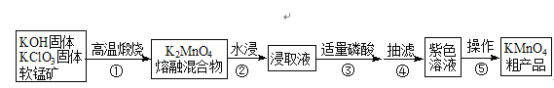
已知:3K2MnO4+2H3PO4═2KMnO4+MnO2↓+2K2HPO4+2H2O
物质 | KMnO4 | K2HPO4 | K2SO4 | CH3COOK | KCl | K2CO3 |
293K溶解度/g | 6.4 | 150 | 11.1 | 217 | 34 | 111 |
(1)原料高温煅烧时选用铁坩埚和铁棒,理由是__________。
(2)①中每生成1molK2MnO4时电子转移2mol,写出化学反应方程式_________。
(3)从反应机理和产物分离角度考虑,③可用磷酸,也可用下列________试剂。
A.醋酸 B.盐酸 C.硫酸 D.CO2
(4)下列描述不正确的是_________。
A.操作⑤中蒸发至大量晶体析出再冷却晶体,趁热过滤
B.抽滤时布氏漏斗中选用大小略小于漏斗内径且盖住全部小孔的滤纸
C.可用无水乙醇洗涤产品提高纯度
D.KMnO4晶体的烘干温度过高会降低产率
(5)粗产品的洗涤步骤可能需要用到以下操作:a.加入洗涤剂至浸没固体;b.洗涤剂缓慢通过;c.洗涤剂快速通过;d.关小水龙头;e.开大水龙头;f.重复2~3次。
请选出正确的操作并排序________。(操作可重复使用)
(6)高锰酸钾产品的纯度测定:准确称取0.7900g产品,配成250mL溶液,量取25.00mL于锥形瓶中,用0.1000molL﹣1(NH4)2Fe(SO4)2标准溶液进行滴定,滴定终点的现象__________。滴定前和滴定后的液面见下图。计算出高锰酸钾的纯度为_______。




