题目内容
一定条件下,发生如下反应:A(g)+2B(g)?xC(g)+D(g)△H<0,x为正整数).
(1)450℃时,向甲、乙两容积均为1L的恒容容器中,分别充入2molA、4molB和1molA、2molB,测得容器内c(A)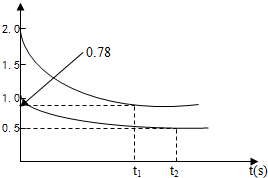 随时间变化如图所示.
随时间变化如图所示.
①x的值为
.
②甲容器内从起始到平衡时,反应速率v(B)
mol/(L?s).
③若向甲容器中再充入2molA、4molB,则达平衡时,A的物质的量浓度的范围:
(2)对(1)反应中达到平衡后的乙容器,升温至600℃时,此时K值应
(3)根据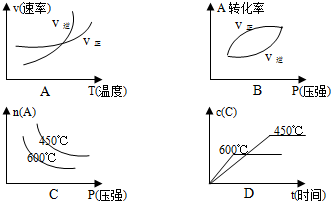 题意,下列曲线符合变化规律的是
题意,下列曲线符合变化规律的是
(4)450℃时甲容器中,判断该反应达到化学平衡状态的依据是
A.容器中压强不变 B.v (B)(正)=2v(C)(逆)
C.容器中密度不变 D.c (A)=c(D)
(1)450℃时,向甲、乙两容积均为1L的恒容容器中,分别充入2molA、4molB和1molA、2molB,测得容器内c(A)
 随时间变化如图所示.
随时间变化如图所示.①x的值为
1
1
;(以下各题均用此数据)平衡常数表达式K=| c(C)×c(D) |
| c(A)×c2(B) |
| c(C)×c(D) |
| c(A)×c2(B) |
②甲容器内从起始到平衡时,反应速率v(B)
| 2.44 |
| t1 |
| 2.44 |
| t1 |
③若向甲容器中再充入2molA、4molB,则达平衡时,A的物质的量浓度的范围:
0.78mol/L
0.78mol/L
<c(A)<1.56mol/L
1.56mol/L
.(2)对(1)反应中达到平衡后的乙容器,升温至600℃时,此时K值应
减小
减小
(填“增大”或“减小”或“不变”).(3)根据
 题意,下列曲线符合变化规律的是
题意,下列曲线符合变化规律的是ABD
ABD
.(4)450℃时甲容器中,判断该反应达到化学平衡状态的依据是
AB
AB
.A.容器中压强不变 B.v (B)(正)=2v(C)(逆)
C.容器中密度不变 D.c (A)=c(D)
分析:(1)①450℃时,向甲、乙两容积均为1L的恒容容器中,分别充入2molA、4molB和1molA、2molB,由图可知,起始c(A)=2mol/L时,转化率为
×100%=61%,起始c(A)=1mol/L时,转化率为
×100%=50,则压强越大,A的转化率越大,即1+2>x+1,所以x=1,K为生成物浓度幂之积与反应物浓度幂之积的比;
②先计算A的反应速率,再利用反应速率之比等于化学计量数之比计算B的反应速率;
③向甲容器中再充入2molA、4molB,则平衡正向移动,A的浓度大于原浓度时浓度,小于原平衡浓度的2倍;
(2)该反应为放热反应,升高温度,平衡逆向移动;
(3)根据升高温度平衡逆向移动、增大压强平衡正向移动,并结合图象来分析;
(4)根据平衡的特征“等”、”定”及由此衍生的一些物理量来分析.
| 2-0.78 |
| 2 |
| 1-0.5 |
| 1 |
②先计算A的反应速率,再利用反应速率之比等于化学计量数之比计算B的反应速率;
③向甲容器中再充入2molA、4molB,则平衡正向移动,A的浓度大于原浓度时浓度,小于原平衡浓度的2倍;
(2)该反应为放热反应,升高温度,平衡逆向移动;
(3)根据升高温度平衡逆向移动、增大压强平衡正向移动,并结合图象来分析;
(4)根据平衡的特征“等”、”定”及由此衍生的一些物理量来分析.
解答:解:(1)①450℃时,向甲、乙两容积均为1L的恒容容器中,分别充入2molA、4molB和1molA、2molB,由图可知,起始c(A)=2mol/L时,转化率为
×100%=61%,起始c(A)=1mol/L时,转化率为
×100%=50,则压强越大,A的转化率越大,即1+2>x+1,所以x=1,反应A(g)+2B(g)?C(g)+D(g)的K=
,
故答案为:1;
;
②由图可知,A的反应速率为
=
mol/(L?s),则由反应速率之比等于化学计量数之比,B的反应速率为
mol/(L?s)×2=
mol/(L?s),
故答案为:
;
③因体积、温度不变,向甲容器中再充入2molA、4molB,则平衡正向移动,A的浓度大于原浓度时浓度,小于原平衡浓度的2倍,即0.78mol/L<c(A)<1.56mol/L,
故答案为:0.78mol/L;1.56mol/L;
(2)该反应为放热反应,升高温度,平衡逆向移动,则由450℃升高为600℃,平衡逆向移动,K减小,故答案为:减小;
(3)A.升高温度,正逆反应速率均增大,且逆反应速率大于正反应速率,与图象一致,故A正确;
B.增大压强,平衡正向移动,正反应速率越大时,A的转化率越大,与图象一致,故B正确;
C.温度越大,平衡逆向移动,A的含量越大,与图象不符,故C错误;
D.温度高,反应速率大,时间少,且温度越大,平衡逆向移动,C的含量少,与图象一致,故D正确;
故答案为:ABD;
(4)A.该反应为反应前后压强不等的反应,则容器中压强不变,反应达到平衡,故A正确;
B.v (B)(正)=2v(C)(逆)=2v(C)(逆),C的正逆反应速率相等,反应达到平衡,故B正确;
C.因气体的总质量不变,体积不变,则容器中密度不变,不能利用密度判断平衡,故C错误;
D.c (A)=c(D)取决于起始浓度和转化率,不能利用其判断平衡,故D错误;
故选AB.
| 2-0.78 |
| 2 |
| 1-0.5 |
| 1 |
| c(C)×c(D) |
| c(A)×c2(B) |
故答案为:1;
| c(C)×c(D) |
| c(A)×c2(B) |
②由图可知,A的反应速率为
| 2.0mol/L-0.78mol/L |
| t1s |
| 1.22 |
| t1 |
| 1.22 |
| t1 |
| 2.44 |
| t1 |
故答案为:
| 2.44 |
| t1 |
③因体积、温度不变,向甲容器中再充入2molA、4molB,则平衡正向移动,A的浓度大于原浓度时浓度,小于原平衡浓度的2倍,即0.78mol/L<c(A)<1.56mol/L,
故答案为:0.78mol/L;1.56mol/L;
(2)该反应为放热反应,升高温度,平衡逆向移动,则由450℃升高为600℃,平衡逆向移动,K减小,故答案为:减小;
(3)A.升高温度,正逆反应速率均增大,且逆反应速率大于正反应速率,与图象一致,故A正确;
B.增大压强,平衡正向移动,正反应速率越大时,A的转化率越大,与图象一致,故B正确;
C.温度越大,平衡逆向移动,A的含量越大,与图象不符,故C错误;
D.温度高,反应速率大,时间少,且温度越大,平衡逆向移动,C的含量少,与图象一致,故D正确;
故答案为:ABD;
(4)A.该反应为反应前后压强不等的反应,则容器中压强不变,反应达到平衡,故A正确;
B.v (B)(正)=2v(C)(逆)=2v(C)(逆),C的正逆反应速率相等,反应达到平衡,故B正确;
C.因气体的总质量不变,体积不变,则容器中密度不变,不能利用密度判断平衡,故C错误;
D.c (A)=c(D)取决于起始浓度和转化率,不能利用其判断平衡,故D错误;
故选AB.
点评:本题考查化学平衡、化学反应速率及图象,明确图象中的坐标、点、线、面的意义及影响平衡移动、反应速率的因素即可解答,(3)为解答的易错点,题目难度中等.

练习册系列答案
相关题目



 2Z(g);△H<0.当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是( )
2Z(g);△H<0.当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是( ) (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)






