题目内容
(2008?乐山一模)将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:X(g)+3Y(g)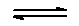 2Z(g);△H<0.当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是( ) 2Z(g);△H<0.当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是( )
|
分析:由反应X(g)+3Y(g) 2Z(g);△H<0可知,正反应放热,升高温度,平衡向逆反应方向移动;增大压强,平衡向正反应方向移动;加入一种反应物,平衡向正反应方向移动;使用催化剂,平衡不发生移动,以此分析此题.
2Z(g);△H<0可知,正反应放热,升高温度,平衡向逆反应方向移动;增大压强,平衡向正反应方向移动;加入一种反应物,平衡向正反应方向移动;使用催化剂,平衡不发生移动,以此分析此题.
 2Z(g);△H<0可知,正反应放热,升高温度,平衡向逆反应方向移动;增大压强,平衡向正反应方向移动;加入一种反应物,平衡向正反应方向移动;使用催化剂,平衡不发生移动,以此分析此题.
2Z(g);△H<0可知,正反应放热,升高温度,平衡向逆反应方向移动;增大压强,平衡向正反应方向移动;加入一种反应物,平衡向正反应方向移动;使用催化剂,平衡不发生移动,以此分析此题.解答:解:①由反应X(g)+3Y(g) 2Z(g);△H<0可知,正反应放热,升高温度,平衡向逆反应方向移动,X的转化率减小,故①正确;
2Z(g);△H<0可知,正反应放热,升高温度,平衡向逆反应方向移动,X的转化率减小,故①正确;
②由化学方程式可知,反应前气体的计量数之和大于反应后气体的化学计量数之和,增大压强,平衡向正反应方向移动,但X转化的不如增加的多,X的浓度反而增大,故②错误;
③充入一定量Y,平衡向正反应方向移动,但增加的Y比反应的多,Y的转化率反而较小,故③错误;
④使用催化剂平衡不移动,故④错误,
所以正确的答案只有①.
故选A.
 2Z(g);△H<0可知,正反应放热,升高温度,平衡向逆反应方向移动,X的转化率减小,故①正确;
2Z(g);△H<0可知,正反应放热,升高温度,平衡向逆反应方向移动,X的转化率减小,故①正确;②由化学方程式可知,反应前气体的计量数之和大于反应后气体的化学计量数之和,增大压强,平衡向正反应方向移动,但X转化的不如增加的多,X的浓度反而增大,故②错误;
③充入一定量Y,平衡向正反应方向移动,但增加的Y比反应的多,Y的转化率反而较小,故③错误;
④使用催化剂平衡不移动,故④错误,
所以正确的答案只有①.
故选A.
点评:本题考查化学平衡移动的影响因素,题目难度不大,本题注意②③为易错点.

练习册系列答案
相关题目
 (2008?乐山一模)将纯锌片和纯铜片按如图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
(2008?乐山一模)将纯锌片和纯铜片按如图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )