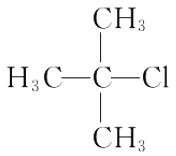
题目内容
【题目】已知氯化铝的熔点为190℃(2.202×l05Pa),但它在180℃即开始升华。
(1)氯化铝是____________。(填“离子化合物”或“共价化合物”)
(2)在500K和1.01×105Pa时,它的蒸气密度(换算为标准状况时)为11.92g·L-1,试确定氯化铝在蒸气状态时的化学式为____________。
(3)无水氯化铝在空气中强烈的“发烟”,其原因是__________。
【答案】共价化合物 Al2Cl6 氯化铝与空气中的水发生水解反应产生HCl气体,HCl在空气中形成酸雾而“发烟”,
【解析】
(1)氯化铝熔点低、以及在较低温度下即开始升华,这两个事实说明其微粒间的作用力较弱,不符合离子化合物的性质,因此判断其为共价化合物;
(2)氯化铝蒸气的相对分子质量为![]() ,所以分子式为Al2Cl6;
,所以分子式为Al2Cl6;
(3)AlCl3在空气中发生水解AlCl3+3H2O![]() Al(OH)3+3HCl,生成的HCl遇到空气中的水蒸气形成盐酸小液滴,故 “发烟”,此烟的本质是雾,同学们需注意。
Al(OH)3+3HCl,生成的HCl遇到空气中的水蒸气形成盐酸小液滴,故 “发烟”,此烟的本质是雾,同学们需注意。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。

如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
A.原子核对核外电子的吸引力 B.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
锂 | X | Y | |
失去第一个电子 | 519 | 502 | 580 |
失去第二个电子 | 7296 | 4570 | 1820 |
失去第三个电子 | 11799 | 6920 | 2750 |
失去第四个电子 | 9550 | 11600 |
(1)通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量_______________________________;
(2)表中X可能为以上13种元素中的______(填写字母)元素。用元素符号表示X和j形成化合物的化学式________;
(3)Y是周期表中_______族元素;
(4)以上13种元素中,_____(填写字母)元素原子失去核外第一个电子需要的能量最多。