题目内容
【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
① 醋酸在水溶液中的电离方程式为 。
② 下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是 (填字母序号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
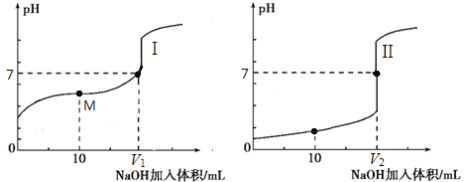
滴定醋酸的曲线是 (填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是 。
③ V1和V2的关系:V1 V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
操作步骤 | 现象 |
步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 | 出现白色沉淀。 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol·L-1 Fe(NO3)3溶液。 | 溶液变红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液。 | 现象a ,溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。 | 出现黄色沉淀。 |
写出步骤2中溶液变红色的离子方程式 。
步骤3中现象a是 。
用化学平衡原理解释步骤4的实验现象 。
【答案】(1)①CH3COOH![]() CH3COO-+H+②b、c
CH3COO-+H+②b、c
(2)①I②0.1mol·L-1醋酸溶液③<④c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
(3)①Fe3++3SCN-![]() Fe(SCN)3(2分)②出现白色沉淀
Fe(SCN)3(2分)②出现白色沉淀
③AgSCN(s)![]() Ag+(aq)+SCN-(aq)(1分),加入KI后,因为溶解度:AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-=AgI↓,AgSCN的溶解平衡正向移动(1分)。(2分)
Ag+(aq)+SCN-(aq)(1分),加入KI后,因为溶解度:AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-=AgI↓,AgSCN的溶解平衡正向移动(1分)。(2分)
【解析】
试题分析:(1)①醋酸是一元弱酸,在溶液中存在电离平衡,则醋酸在水溶液中的电离方程式为CH3COOH![]() CH3COO-+H+。②a.滴加少量浓盐酸,氢离子浓度增大,抑制醋酸电离,电离程度减小,a错误;b.电离吸热,微热溶液促进电离,电离程度增大,b正确;c.加水稀释粗电离,电离程度增大,c正确;d.加入少量醋酸钠晶体,增大醋酸根浓度,抑制醋酸电离,电离程度减小,答案选bc。
CH3COO-+H+。②a.滴加少量浓盐酸,氢离子浓度增大,抑制醋酸电离,电离程度减小,a错误;b.电离吸热,微热溶液促进电离,电离程度增大,b正确;c.加水稀释粗电离,电离程度增大,c正确;d.加入少量醋酸钠晶体,增大醋酸根浓度,抑制醋酸电离,电离程度减小,答案选bc。
(2)①醋酸是弱酸,0.1mol/L醋酸溶液的pH大于1,则滴定醋酸的曲线是I。
②盐酸和氢氧化钠溶液均是一元的强酸和强碱,在浓度相等的条件下对水的电离程度影响是相同的。醋酸是一元弱酸,在浓度与盐酸相等的条件下,溶液中氢离子浓度小,对水的电离程度影响小于盐酸,则滴定开始前,三种溶液中由水电离出的c(H+)最大的是0.1mol/L醋酸。
③氢氧化钠和醋酸恰好反应时生成的醋酸钠水解溶液显碱性,要满足溶液显中性,则醋酸应该过量。而氢氧化钠与盐酸恰好反应时生成的氯化钠不水解,溶液显中性,所以V1小于V2。
④M点时醋酸过量,溶液是由等浓度的醋酸钠和醋酸构成的,溶液显酸性,则对应的溶液中,各离子的物质的量浓度由大到小的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。
(3)①铁离子与KSCN溶液反应使溶液显红色,反应的离子方程式为Fe3++3SCN-![]() Fe(SCN)3。
Fe(SCN)3。
②硝酸银溶液能与KSCN溶液反应产生白色沉淀,所以向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液时溶液中仍然会出现白色沉淀。
③根据以上分析可知溶液中存在平衡AgSCN(s)![]() Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,因此Ag+与I-反应生成AgI黄色沉淀:Ag++I-=AgI↓,从而导致AgSCN的溶解平衡正向移动。
Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,因此Ag+与I-反应生成AgI黄色沉淀:Ag++I-=AgI↓,从而导致AgSCN的溶解平衡正向移动。

 名校课堂系列答案
名校课堂系列答案【题目】科学家在利用无土栽培法培养一些名贵花卉时,培养液中添加了多种必需化学元素,其配方如下:
离子 | K+ | Na+ | Mg2+ | Ca2+ | NO3— | H2PO42— | SO42— | Zn2+ |
培养液浓度(g/L) | 1 | 1 | 0.25 | 1 | 2 | 1 | 0.25 | 1 |
其中花卉根细胞吸收最少的离子是
A. Ca2+ B. SO42— C. Zn2+ D. H2PO42—