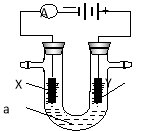
��Ŀ����
����Ŀ��ij�о���ѧϰС������ȷ�Ӧʵ��չ���о������и��л�ѧ�̲��жԡ����ȷ�Ӧ�� ������������������������Ӧ�ų��������ȣ�������ҫ�۵Ĺ�â������ֽ©�����²����մ����� ����������ɳ�С������ġ���ѧ�ֲᡷ֪��Al��Al2O3��Fe��Fe2O3���ۡ��е��������£�
���� | Al | Al2O3 | Fe | Fe2O3 |
�۵�/�� | 660 | 2 054 | 1535 | 1462 |
�е�/�� | 2467 | 2980 | 2750 | �� |
I.��1��ijͬѧ�Ʋ⣬���ȷ�Ӧ���õ���������Ӧ�������Ͻ������ǣ��÷�Ӧ�ų�������ʹ���ۻ����������۵�����ĵͣ���ʱҺ̬���������ۺ��γ������Ͻ�����Ϊ���Ľ����Ƿ������________(�������������������
��2����֭һ����ʵ�鷽����֤���������õĿ�״�������к��н���������ʵ�������Լ���________����Ӧ�����ӷ���ʽΪ___________��
II.ʵ���о����֣����ᷢ��������ԭ��Ӧʱ�������Ũ��Խϡ����Ӧ��ԭ�����е�Ԫ�صĻ��ϼ�Խ�͡�ijͬѧȡһ������������������һ������ϡ�������ַ�Ӧ����Ӧ������������ų�������������ΪFe3+���ڷ�Ӧ���������Һ�У���μ���4mol/L������������Һ����������������Һ�������mL)������ij��������ʵ�����mol���Ĺ�ϵ��ͼ��ʾ��
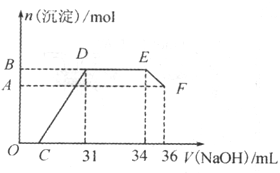
�ش��������⣺
��1��ͼ��OC��û�г������ɣ��˽η�����Ӧ�����ӷ���ʽΪ____________����DE�Σ����������ʵ���û�б仯����˽η�����Ӧ�����ӷ���ʽΪ____________��
��2��B��A�IJ�ֵΪ_________mol��B���Ӧ�ij��������ʵ���Ϊ___________mol��C���Ӧ������������Һ�����Ϊ____________mL��
���𰸡�I��1������ ��2��NaOH��Һ 2Al+2OH-+2H2O=2AlO2-+3H2����
II��1�� H++OH-=H2O NH4++OH-=NH3��H2O����2��0.008 0.032mol 7mL
�����������������I����1���÷�Ӧ�ų�������ʹ���ۻ����������۵�����ͣ���ʱ��Ӧ������Һ̬�������������ۺ��γ������Ͻ��������Ľ����Ǻ����ģ�
��2������Al�ܹ���ǿ����Һ������Ӧ������������Fe��Al���ܷ�����Ӧ�����ʼ�����֤�����Ը�ʵ�������Լ���NaOH��Һ����Ӧ�Ļ�ѧ����ʽ�ǣ�2Al+2OH-+2H2O=2AlO2-+3H2����
II����1�����������ܽ�ý�������Һ�м���NaOH��Һ������������������������������NaOH������������ᷢ���кͷ�Ӧ������OC�����ӷ���ʽ�ǣ�H++OH-=H2O��
��2����CD����Һ�е�Fe3+��Al3+����������Ӧ�γ�Fe(OH)3��Al(OH)3��������DE�Σ����������ʵ���û�б仯������Ϊ��DE��NaOH��Һ�����ᱻ��ԭΪNH4NO3,���߷������ֽⷴӦ�����ӷ���ʽ�ǣ�NH4++ OH-=NH3��H2O��
��3����EF��NaOH�ܽ�Al(OH)3���������ӷ���ʽ�ǣ�Al(OH)3+ OH-=AlO2-+ 2H2O���ܽ�Al(OH)3���ĵ�NaOH�����ʵ�����n(NaOH)=4mol/L��0.002L=0.008mol�����Ը��ݷ�Ӧ����ʽ�ж��ߵ����ʵ�����ϵ��֪��n(Al(OH)3)=0.008mol������Al(OH)3�������ĵ�NaOH��Һ�������6mL�����ݷ�Ӧ����ʽNH4++ OH-=NH3��H2O ��֪��n(NH4+) = 4mol/L �� 0.003L = 0.012mol��n(e-) =" 0.012mol" �� 8 = 0.096mol��Fe��Al����+3�۵Ľ����������ڷ�Ӧ�����е���ת����Ŀ��ȣ�����n(Fe)+n(Al) =" 0.096mol��3" = 0.032mol��������B���Ӧ�ij��������ʵ�������������ʵ�����ȣ�Ϊ0.032mol��ʹAl3+��Fe3+�γɳ������ĵ�NaOH�����ʵ�������ӵ����ʵ�����ȣ���0.096mol����������NaOH��Һ�������V��NaOH�� =" 0.096mol" ��4mol/L =" 0.024L" = 24mL������ C���Ӧ������������Һ�����Ϊ31mL-24mL = 7mL��