题目内容
下列溶液中含Cl-物质的量浓度最大的是( )
| A、5mL 0.1mol?L-1的氯化铝溶液 | B、10mL 0.1mol?L-1的氯化钙溶液 | C、30mL 0.2mol?L-1的氯化钾溶液 | D、40mL 0.25mol?L-1的氯化钠溶液 |
分析:根据溶液中C(Cl-)=溶质的物质的量浓度×化学式中氯离子个数,与溶液的体积无关.
解答:解:A、5mL 0.1mol?L-1的氯化铝溶液中C(Cl-)=3C(AlCl3)=0.1mol/L×3=0.3mol?L-1;
B、10mL 0.1mol?L-1的氯化钙溶液中C(Cl-)=2C(CaCl2)=0.1mol/L×2=0.2mol?L-1;
C、30mL 0.2mol?L-1的氯化钾溶液中C(Cl-)=C(KCl)=0.2mol?L-1;
D、40mL 0.25mol?L-1的氯化钠溶液中C(Cl-)=C(NaCl)=0.25mol/L;
所以氯离子浓度最大的是0.3mol/L;
故选:A.
B、10mL 0.1mol?L-1的氯化钙溶液中C(Cl-)=2C(CaCl2)=0.1mol/L×2=0.2mol?L-1;
C、30mL 0.2mol?L-1的氯化钾溶液中C(Cl-)=C(KCl)=0.2mol?L-1;
D、40mL 0.25mol?L-1的氯化钠溶液中C(Cl-)=C(NaCl)=0.25mol/L;
所以氯离子浓度最大的是0.3mol/L;
故选:A.
点评:本题考查了物质的量浓度的有关计算,根据溶液中C(Cl-)=溶质的物质的量浓度×化学式中氯离子个数来解答即可.

练习册系列答案
相关题目

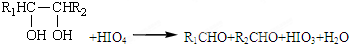
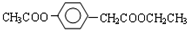
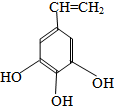 、
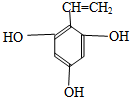
、
 含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感.
含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感.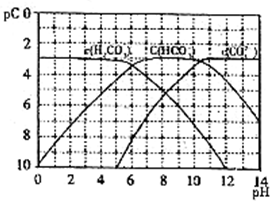 pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡: pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:
 ?
?
 、
、 在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.请回答下列问题:
在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.请回答下列问题: 的pC最大值为______(溶液中的离子浓度小于1×10-5mol/L时,沉定完全).
的pC最大值为______(溶液中的离子浓度小于1×10-5mol/L时,沉定完全). 的物质的量之比为2:1,则滴入的盐酸中HCl的物质的量等于______mol.
的物质的量之比为2:1,则滴入的盐酸中HCl的物质的量等于______mol.