题目内容
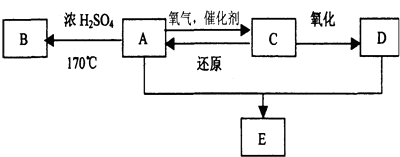
【题目】乙二酸﹣1,4﹣环己二醇酯可以通过下列路线合成.请回答下列问题: 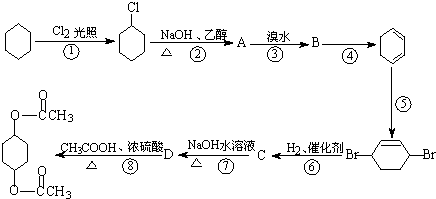
(1)上述反应①﹣④中,属于取代反应的有(填序号);
反应⑥﹣⑧中,属于加成反应的有(填序号).
(2)写出下列物质的结构简式:B , C .
(3)写出下列反应的方程式:
反应②:;
反应⑦: .
【答案】
(1)①;⑥
(2)![]() ;
;![]()
(3) ;
;![]()
【解析】解:由合成路线可知,反应①为光照条件下的取代反应,反应②为卤代烃在NaOH/醇条件下发生消去反应,则A为 ![]() ,A与溴水发生加成反应生成B为
,A与溴水发生加成反应生成B为 ![]() ,B在NaOH/醇条件下发生消去反应生成1,3﹣环己二烯,反应⑤发生为1,4﹣加成反应,反应⑥为碳碳双键与氢气发生加成反应生成C为
,B在NaOH/醇条件下发生消去反应生成1,3﹣环己二烯,反应⑤发生为1,4﹣加成反应,反应⑥为碳碳双键与氢气发生加成反应生成C为 ![]() ,C在NaOH/水条件下发生水解反应生成D为
,C在NaOH/水条件下发生水解反应生成D为 ![]() ,反应⑧为醇与乙酸的酯化反应.
,反应⑧为醇与乙酸的酯化反应.
(1.)上述反应①﹣④中,反应①属于取代反应,反应②④属于消去反应,反应③属于加成反应,反应⑥﹣⑧中,反应⑥属于加成反应,反应⑦⑧属于取代反应,所以答案是:①;⑥;
(2.)由上述分析可知,B的结构简式为 ![]() ,C的结构简式为
,C的结构简式为 ![]() ,所以答案是:
,所以答案是: ![]() ;
; ![]() ;
;
(3.)反应②的化学反应方程式为:  ,
,
反应⑦的化学反应方程式为: ![]() ,所以答案是:
,所以答案是:  ;
; ![]() .
.

【题目】(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下。
2P(s) + 3Cl2(g) = 2PCl3(g) ΔH= -612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) ΔH= -798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为__________________________________
(2)不同温度下反应CO(g) + H2O(g)![]() CO2(g) + H2(g) ΔH的平衡常数如下表所示。
CO2(g) + H2(g) ΔH的平衡常数如下表所示。
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
则ΔH______0(填“<”“>”);在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)= 0.005mol/L、c(H2)= 0.015mol/L,则CO的平衡转化率为______。
(3)在一定体积的绝热密闭容器中,对于反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是__________
2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是__________
A. SO2和SO3浓度相等 B. 容器中混合气体的密度保持不变
C. 容器中气体的压强保持不变 D. SO3的生成速率与SO2的生成速率相等
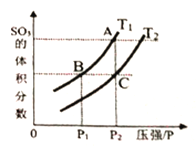
当温度为T1、T2时,平衡体系SO3的体积分数随压强变化曲线如上图所示。则T1______T2 (填“>”或“<");如果想加快正反应的速率,除了改变温度,还可以用___________方法。