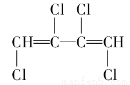
题目内容
海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表的________族。
(2)目前,国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸气,蒸气经冷却而得高纯度的淡水。由此可判断蒸馏法是________(填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品。反应式为:
NaCl+H2O NaOH+H2↑+Cl2↑(未配平),该反应中NaCl的电子式是______;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐______t。(可能用到的相对原子质量:Na:23,Cl:35.5,H:1,O:16)
NaOH+H2↑+Cl2↑(未配平),该反应中NaCl的电子式是______;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐______t。(可能用到的相对原子质量:Na:23,Cl:35.5,H:1,O:16)
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下图:
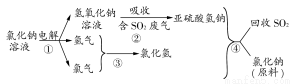
请写出②④的化学反应方程式:________、________。
(1)ⅠA
(2)物理变化
(3) 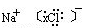 585
585
(4)NaOH+SO2=NaHSO3 NaHSO3+HCl=NaCl+H2O+SO2↑
【解析】(1)氯化钠中的金属元素为钠,它应位于元素周期表的ⅠA族。
(2)将海水蒸馏变成水蒸气属于物理变化。
(3)NaCl的电子式为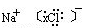 ,要制36.5%的浓盐酸1000 t所消耗的食盐应为
,要制36.5%的浓盐酸1000 t所消耗的食盐应为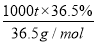 ×58.5 g/mol=585 t。
×58.5 g/mol=585 t。
(4)由图示给出的反应物和生成物不难写出②的反应方程式为NaOH+SO2=NaHSO3,④的反应方程式为NaHSO3+HCl=NaCl+H2O+SO2↑。

某化学兴趣小组在探究卤素单质的氧化性的实验中发现,在足量的氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色,原因是什么?Br2能否氧化Fe2+,Fe3+与Br2谁的氧化性更强?
(1)甲同学认为:Br2不能氧化Fe2+,Fe3+的氧化性大于Br2,产生上述现象的原因不是化学反应所致,溶液呈黄色是含 (填化学式,下同)所致。
(2)乙同学认为:Br2将Fe2+氧化为Fe3+,Fe3+的氧化性小于Br2,产生上述现象的原因是化学反应所致,则溶液呈黄色是含 所致。
(3)丙同学为验证乙同学的观点,选择下列试剂,设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的,供选用的试剂:a.酚酞试剂;b.CCl4;c.无水酒精;d.KSCN溶液。请你在下表中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
选用试剂 | 实验现象 |
方案1 |
|
方案2 |
|
(4)氧化性:Br2>Fe3+,故在FeCl2中滴入1~2滴溴水,溶液呈黄色。发生反应的离子方程式是 。
(5)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是 。在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有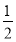 的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度是 。
的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度是 。