题目内容
AgCl(s) Ag+(aq)+Cl-(aq),平衡时,Ksp=C(Ag+ )·C(Cl-)
,过量氯化银分别投入①100 mL水
②24 mL 0.1 mol·L-1NaCl ③10 mL 0.1 mol·L-1MgCl2 ④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中C(Ag+)由大到小顺序为
Ag+(aq)+Cl-(aq),平衡时,Ksp=C(Ag+ )·C(Cl-)
,过量氯化银分别投入①100 mL水
②24 mL 0.1 mol·L-1NaCl ③10 mL 0.1 mol·L-1MgCl2 ④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中C(Ag+)由大到小顺序为
A、③①②④ B、④①②③ C、①②③④ D、④③②①
【答案】
B
【解析】
试题分析:对于AgCl(s)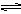 Ag+(aq)+Cl-(aq),温度一定时,Ksp=C(Ag+ )·C(Cl-)为常数
Ag+(aq)+Cl-(aq),温度一定时,Ksp=C(Ag+ )·C(Cl-)为常数
溶液中Cl-浓度越小,Ag+浓度越大,结合题给数据分析即可,选B
考点:考查难溶物的沉淀溶解平衡,溶度积常数的应用。

练习册系列答案
相关题目
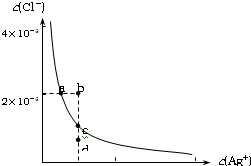 某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示(提示:AgCl(s)
某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示(提示:AgCl(s) Ag+(aq)+Cl-(aq),其平衡常数Ksp=c(Ag+)?c(Cl-),称为溶度积常数;又知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50).下列说法正确的是( )
Ag+(aq)+Cl-(aq),其平衡常数Ksp=c(Ag+)?c(Cl-),称为溶度积常数;又知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50).下列说法正确的是( )