题目内容
13.氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质.为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作.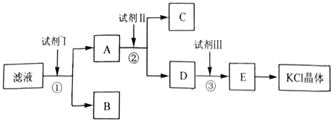
回答下列问题:
(1)试剂Ⅰ的化学式为BaCl2,加试剂I后进行的实验操作为过滤.
(2)试剂Ⅱ的化学式为K2CO3,②中加入试剂Ⅱ的目的是除去多余的钡离子;
(3)试剂Ⅲ的名称是盐酸,③中发生反应的化学方程式为K2CO3+2HCl=KCl+H2O+CO2↑;
(4)某同学称取提纯的产品1.0g,溶解后定容在100mL容量瓶中,取25.0mL溶液,用0.1mol•L-1的硝酸银溶液沉淀,消耗硝酸银溶液的体积为10.0mL,该产品的纯度为29.8%.
分析 氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质,除去碳酸根离子和硫酸根离子,需要加入过量氯化钡溶液,则试剂I为BaCl2;然后过滤后获得A中含碳酸钾、氯化钾,再加入过量的碳酸钾溶液除去溶液中过量的氯化钡,则试剂Ⅱ为K2CO3,过滤,得到氯化钾和碳酸钾混合液,再加入试剂Ⅲ为过量盐酸,除去过量的碳酸钾,最后通过加热浓缩、蒸发结晶得到KCl晶体,以此来解答.
解答 解:氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质,除去碳酸根离子和硫酸根离子,需要加入过量氯化钡溶液,则试剂I为BaCl2;然后过滤后获得A中含碳酸钾、氯化钾,再加入过量的碳酸钾溶液除去溶液中过量的氯化钡,则试剂Ⅱ为K2CO3,过滤,得到氯化钾和碳酸钾混合液,再加入试剂Ⅲ为过量盐酸,除去过量的碳酸钾,最后通过加热浓缩、蒸发结晶得到KCl晶体,
(1)由上述分析可知试剂I为BaCl2,加试剂I后进行的实验操作为过滤,故答案为:BaCl2;过滤;
(2)由上述分析可知,Ⅱ为K2CO3,目的是除去多余的钡离子,故答案为:K2CO3;除去多余的钡离子;
(3)由上述分析可知,试剂Ⅲ为过量盐酸,发生的反应为,故答案为:盐酸;K2CO3+2HCl=KCl+H2O+CO2↑;
(4)取25.0mL溶液,用0.1mol•L-1的硝酸银溶液沉淀,消耗硝酸银溶液的体积为10.0mL,则n(KCl)=$\frac{0.1mol/L×0.01L}{0.025L}$=0.04mol,
则纯度为$\frac{0.04mol×74.5g/mol×4}{1.0g}$×100%=29.8%,故答案为:29.8%.
点评 本题考查混合物的分离、提纯,为高频考点,侧重于考查学生分析能力、实验能力,注意把握流程中的反应及混合物分离方法的选择,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 家用电器起火 常用液态CO2灭火 一般不用液态四氯化碳 | |
| B. | 将一氧化碳中毒者移到通风处抢救 | |
| C. | 眼睛里不慎溅进了药液 应立即用水冲洗 边洗边眨眼睛 不可用手揉眼睛 | |
| D. | 实验后 剩余的药品不能随便丢弃 或浪费 应放回原瓶 |
| A. | 向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- | |
| B. | 金属钠跟水反应:2Na+2H2O=2Na++2OH-+H2↑ | |
| C. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ | |
| D. | 用醋酸除水垢(主要成分为碳酸钙):2H++CO32-=CO2↑+H2O |
①28g氮气所含有的原子数目为NA
②4g金属钙变成钙离子时失去的电子数目为0.1NA
③在常温常压下,11.2L N2含有的分子数为0.5NA
④0.1NA硫酸分子与8.8g CO2含有相同的氧原子数
⑤0.5mol单质铝与足量盐酸反应转移电子数为1.5NA
⑥标准状况下,22.4L水所含分子数为NA
⑦17g氨气所含电子数目为10NA.
| A. | ①②⑤⑥⑦ | B. | ①②④⑤⑥ | C. | ⑤⑦ | D. | ④⑤⑦ |
| A. | 氢氧化钠的摩尔质量为40g | |
| B. | 1摩尔氧原子的质量就是氧的相对原子质量 | |
| C. | H2SO4的摩尔质量为96g•mol-1 | |
| D. | 1molCO2的质量以克为单位时,在数值上等于CO2的相对分子质量 |

 某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质.他们采用了以下操作制备胶体,请将空白处填写完整.
某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质.他们采用了以下操作制备胶体,请将空白处填写完整.