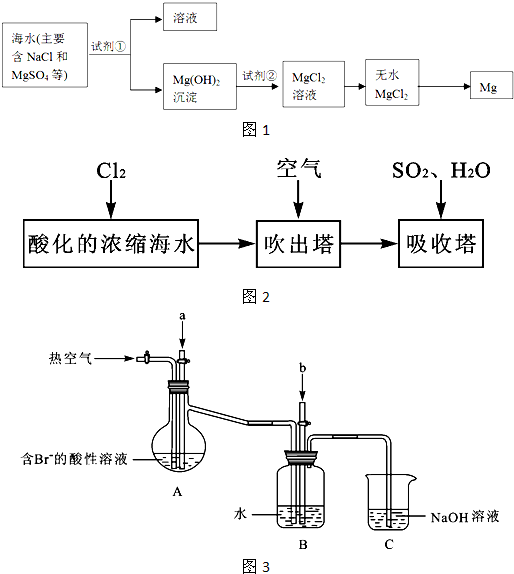
题目内容
海水提溴的过程是提取NaCl后的浓缩卤水中,通入过量Cl2反应后,用空气吹出溴蒸气,用热碱液吸收后,再加入H2SO4酸化,经蒸馏可得液溴。(1)浓缩卤水中通入Cl2的离子反应为__________。
(2)用空气吹出Br2并用热碱液吸收的目的和化学反应是__________________。
(3)用H2SO4酸化的原理是___________________。
(4)生产所用Cl2、NaOH的主要来源是___________________。
(1)Cl2+2Br-![]() Br2+2Cl-
Br2+2Cl-
(2)用空气吹出Br2后用热碱液吸收,使溴得到富集 3Br2+6OH-![]() 5Br-+
5Br-+![]() +3H2O
+3H2O
(3)5Br-+![]() +6H+
+6H+![]() 3Br2+3H2O
3Br2+3H2O
(4)电解饱和食盐水
解析:(1)浓缩卤水中含有低浓度NaBr,通入Cl2时发生的离子反应是Cl2+2Br-![]() Br2+2Cl-。(2)通过上面置换反应得到的Br2的浓度很低,难以收集,用空气吹出Br2后用热碱液吸收,使溴得到富集,这个反应的离子方程式是3Br2+6OH-
Br2+2Cl-。(2)通过上面置换反应得到的Br2的浓度很低,难以收集,用空气吹出Br2后用热碱液吸收,使溴得到富集,这个反应的离子方程式是3Br2+6OH-![]() 5Br-+
5Br-+![]() +3H2O。(3)加H2SO4使溶液呈酸性,Br-与
+3H2O。(3)加H2SO4使溶液呈酸性,Br-与![]() 间发生氧化还原反应,重新生成Br2(高浓度):5Br-+
间发生氧化还原反应,重新生成Br2(高浓度):5Br-+![]() +6H+
+6H+![]() 3Br2+3H2O,经蒸馏可得液溴。(4)生产所用Cl2和NaOH可由电解饱和食盐水制得。这个电化学反应方程式是
3Br2+3H2O,经蒸馏可得液溴。(4)生产所用Cl2和NaOH可由电解饱和食盐水制得。这个电化学反应方程式是
2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑

练习册系列答案
相关题目
海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
| A、海水提溴的过程中,没有发生氧化还原反应 | B、海水中的氘(含HDO 0.03%)发生聚变的能量,足以保证人类上亿年的能源消费,HDO与H2O化学性质不同 | C、从海水中可以得到NaCl,电解熔融NaCl可制备金属钠 | D、利用蒸馏原理从海水中提取淡水是海水淡化技术发展的新方向 |