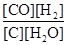题目内容
T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH <0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法正确的是
CH3OH(g)+H2O(g) ΔH <0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法正确的是
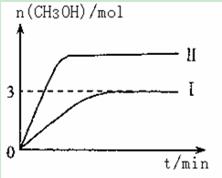
 CH3OH(g)+H2O(g) ΔH <0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法正确的是
CH3OH(g)+H2O(g) ΔH <0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法正确的是
| A.曲线II对应的条件改变是减小压强 |
| B.若T2°C时上述反应的平衡常数为0.42,则T2< T1 |
| C.在T10C,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H2O(g),则达平衡前v(正)>v(逆) |
| D.在T10C,若起始时向容器中通入4 .5 molCO2、6mol H2 ,平衡时容器内的压强P1=P/2 |
C
试题分析:A.该反应是一个反应前后气体体积减小的放热反应,曲线II到达平衡所需时间较短,说明改变条件时反应速率加快,平衡时甲醇的物质的量增大,说明平衡向正反应方向移动,则改变的条件只能是增大压强,故A错误;B.T1℃时,各物质的平衡浓度分别为:c(CH3OH)=c(H2O)="3mol" 3L =1mol/L,c(CO2)=(9?3)mol 3L =2mol/L,c(H2)=(12?3×3)mol 3L =1mol/L,则平衡常数K="1×1/" 2×1×1 =0.5>0.42,平衡向逆反应方向移动平衡常数减小,所以T2>T1,故B错误;C.T1℃时,若起始时向容器中充入 5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H2O(g),则各物质的浓度分别为:c(CH3OH)=c(H2O)=c(CO2)=c(H2)="5" /3 mol/L,则浓度商="(5" /3 )2 /(5/ 3 )4 =0.36<0.5,则平衡向正反应方向移动,则达平衡前v(正)>v(逆),故C正确;D.T1℃时,若起始时向容器由充入4.5molCO2、6mol H2,如果转化率相同,则压强是I的一半,实际上,相对于I来说,相当于减小压强,平衡向逆反应方向移动,则压强大于原来的一半,故D错误;

练习册系列答案
相关题目
 pC(g)+qD(g) △H<0。下列结论中错误的是( )
pC(g)+qD(g) △H<0。下列结论中错误的是( ) 2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相同)
2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相同)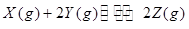 、②
、② 分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板。反应开始和达到平衡状态时有关物理量的变化如图所示: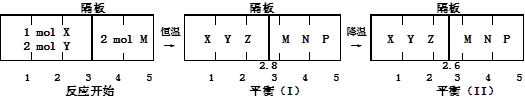
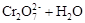

 ,下列说法正确的是
,下列说法正确的是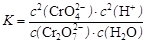
 C(g) + 2D(g)达平衡时C的含量为m%,保持温度不变,若按下列配比的物质放入该容器中,达平衡时C的含量仍为m%的是( )
C(g) + 2D(g)达平衡时C的含量为m%,保持温度不变,若按下列配比的物质放入该容器中,达平衡时C的含量仍为m%的是( ) NH3·H2O
NH3·H2O NH4++OH-;②气体的溶解度随温度的升高而降低。实验室中也常用氨水滴入生石灰中制取氨气,请用平衡的有关理论来解释之。
NH4++OH-;②气体的溶解度随温度的升高而降低。实验室中也常用氨水滴入生石灰中制取氨气,请用平衡的有关理论来解释之。 CO(g)+H2(g) ;ΔH >0,下列有关说法正确的是
CO(g)+H2(g) ;ΔH >0,下列有关说法正确的是