题目内容
【题目】某兴趣小组探究SO2气体还原Fe3+、I2 , 他们使用的药品和装置如下图所示: 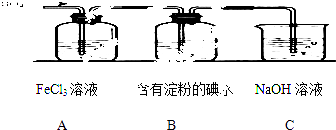
(1)装置C的作用是 .
(2)若要从FeSO4溶液获得FeSO47H2O晶体,必须进行的实验操作步骤:、、过滤、洗涤、自然干燥.
(3)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应.
①写出SO2与FeCl3溶液反应的离子方程式;
②请写出检验A烧杯中有Fe2+生成的操作方法;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42﹣ . 该做法(填“合理”或“不合理”),理由是 .
(4)能表明I﹣的还原性弱于SO2的现象是 .
【答案】
(1)除去多余的SO2 , 防止污染大气
(2)蒸发浓缩;冷却结晶
(3)2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+;取A烧杯中少量溶液,滴加高锰酸钾溶液,如果退色则说明含有二价铁离子,反之没有;不合理;硝酸具有氧化性,亚硫酸根可以被硝酸氧化成硫酸根离子
(4)B中蓝色褪去
【解析】解:(1)二氧化硫气体是酸性氧化物,具有刺激性气味,直接排放会污染大气,由于二氧化硫能和碱反应生成盐和水,可用碱液处理二氧化硫,所以装置C的作用为:吸收SO2尾气,防止污染空气,所以答案是:除去多余的SO2 , 防止污染大气;(2)蒸发蒸发浓缩、冷却结晶是从溶液中获得晶体常采用的方法,产生沉淀后通过过滤实现分离,所以答案是:蒸发浓缩;冷却结晶;(3)①因为二氧化硫具有还原性,三价铁具有氧化性,则二氧化硫与铁离子反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+ , 所以答案是:2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+;②一般检验有Fe2+生成先用KSCN溶液无现象,再用氯水氧化亚铁离子生产三价铁溶液变红来检验,但是现在溶液中还可能含有三价铁,所以不能用KSCN溶液和氯水来检验,选用高锰酸钾溶液,具体操作为:取A烧杯中少量溶液,滴加高锰酸钾溶液,如果退色则说明含有二价铁离子,反之没有;所以答案是:取A烧杯中少量溶液,滴加高锰酸钾溶液,如果退色则说明含有二价铁离子,反之没有;③亚硫酸根能与硝酸发生氧化还原反应生产硫酸根,所以不可证明反应生成了SO42﹣ , 该方法不合理,所以答案是:不合理;硝酸具有氧化性,亚硫酸根可以被硝酸氧化成硫酸根离子;(4)B中蓝色褪去,说明二氧化硫和碘单质反应,I2+SO2+2H2O=2HI+H2SO4 , 依据氧化还原反应中还原剂的还原性大于还原产物,二氧化硫还原性大于碘离子,所以答案是:B中蓝色褪去.

