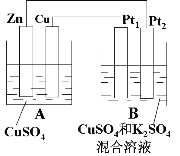
题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,6.0g NO和2.24L O2混合,所得气体的分子数目为0.2NA
B. 常温常压下,0.1mol Na2O和Na2O2组成的混合物中,阴离子的数目为0.1NA
C. C2H4和C3H6的混合物的质量为mg,所含碳氢键的数目为3m/14NA
D. 1mol甲基(![]() )所含的电子数为7NA
)所含的电子数为7NA
【答案】B
【解析】A. 标准状况下,6.0g NO是0.2mol,2.24L O2是0.1mol,二者混合反应生成0.2molNO2,但NO2存在平衡关系:2NO2![]() N2O4,所得气体的分子数目小于0.2NA,A错误;B. Na2O和Na2O2中阴阳离子个数之比均是1:2,常温常压下,0.1mol Na2O和Na2O2组成的混合物中,阴离子的数目为0.1NA,B正确;C. C2H4和C3H6的最简式均是CH2,因此C2H4和C3H6的混合物的质量为mg,所含碳氢键的数目为m/7NA,C错误;D. 1mol甲基(
N2O4,所得气体的分子数目小于0.2NA,A错误;B. Na2O和Na2O2中阴阳离子个数之比均是1:2,常温常压下,0.1mol Na2O和Na2O2组成的混合物中,阴离子的数目为0.1NA,B正确;C. C2H4和C3H6的最简式均是CH2,因此C2H4和C3H6的混合物的质量为mg,所含碳氢键的数目为m/7NA,C错误;D. 1mol甲基(![]() )所含的电子数为9NA,D错误,答案选B。
)所含的电子数为9NA,D错误,答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】工业上制取CuCl2的生产流程如下:

请结合下表数据,回答下列问题:
物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
⑴ 溶液A中加入NaClO的目的是 ;
此反应离子方程式为 ;
⑵ 在溶液B中加入CuO的作用是 ;
⑶ 操作a的目的是 ;
⑷ 在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是 。
【题目】镁及其化合物在现代工业中有着广泛的用途。
(1)组成为Mg17Al12的镁铝合金是一种潜在的贮氢材料,当其贮氢最达到最大值时组成变为“17MgH2+12Al”,则Mg、Al、Mg17Al12三种物质按熔点由高到低的顺序排列为_______, 1mol“17MgH2+12Al”与足量Na0H溶液反应时生成的气体的质量是___________g。
(2)镁可与SiO2发生多种反应,且条件不同时得到的产物也不同。当二者在高温条件下发生置换反应时.还原产物是_________,若镁过量,则产物为两种镁的二元化合物,写出反应的化学方程式:______。
(3)碱式碳酸镁[MgCO3·3H2O]是重要的化工原料,下图表示的是制备它的一种工艺流程。
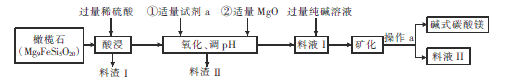
开始沉淀时的PH | 完全沉淀时的pH | |
Fe(OH)3 | 2.7 | 3.7 |
Mg(OH)2 | 9.7 | 11 |
① Mg9FeSi5O20中铁元素的化合价为____,pH的调节范围是______.
② 试剂a是一种常用的绿色氧化剂,加入a后反应的离子方程式为__________。
③ 写出料渣Ⅱ的一种用途:______。一般认为c(Mg2+)≤1×10-5mol/L时,Mg2+已完全沉淀,则Mg(OH)2的Ksp=______。写出生成碱式碳酸镁的离子方程式:____________。