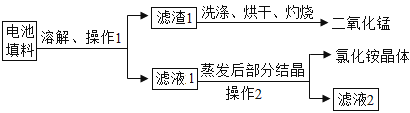
��Ŀ����
����Ŀ��������BN����һ����Ҫ�Ĺ����մɲ��ϣ���ش��������⣺
��1����̬Bԭ�ӵĵ����Ų�ʽΪ___________��B��N��ȣ��縺�Խϴ����_________��
��2����BF3�����У� Bԭ�ӵ��ӻ��������Ϊ___________�� BF3���ӵĿռ乹��Ϊ_____________��
��3�������������ڸ��¸�ѹ�£�����ת��Ϊ��������������ṹ����ʯ���ƣ� Ӳ������ʯ�൱�������߳�Ϊ361.5pm�������������к���__________����ԭ�ӡ�������������ܶ���___________g��cm-3��ֻҪ������ʽ�����ؼ������ֵ������٤������ΪNA����
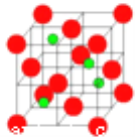
���𰸡���1����1��1s22s22p1��2�֣� N ��2�֣�
��2�� sp2�� ƽ�������� ����1�֣���2�֣�
��3�� 4��1�֣� ![]() ����2�֣�
����2�֣�
��������
�����������1��Bԭ�Ӻ�����5�����ӣ����ݹ���ԭ����д���̬ԭ�Ӻ�������Ų�ʽΪ1s22s22p1��ͬ����Ԫ�أ��縺������ԭ������������������Ե縺��N��B��
��2�����ݼ۲���ӶԻ�������ȷ��ԭ���ӻ���ʽ�����ռ乹�ͣ�BF3������Bԭ�Ӽ۲���ӶԸ�����3�Ҳ����µ��Ӷԣ�����BF3������B����sp2�ӻ������ӹ���Ϊƽ�������Ρ�
��3���þ��������Bԭ��λ�ڶ���������ϣ���Nԭ��λ�ھ����ڲ�����һ�����������������Bԭ������һ��Nԭ�ӣ����Ըþ�����Bԭ�Ӹ���=8��1/8+6��1/2=4��Nԭ�Ӹ���Ϊ4���þ����߳�=361.5pm=361.5��10-10cm�����=��361.5��10-10cm��3���ܶ�=��M/NA��4����V=![]() ��
��