题目内容
13.在下列物质中:NaOH、Na2S、(NH4)2S、Na2O2、C2H2、SiC.(1)其中只含有离子键的离子晶体是Na2S;
(2)其中含有极性共价键的原子晶体是SiC;
(3)其中既含有离子键,又含有极性共价键和配位键的离子晶体是(NH4)2S;
(4)其中既含有离子键又含有非极性共价键的离子晶体是Na2O2;
(5)其中含有非极性共价键和π键的分子晶体是C2H2;
(6)其中既含有离子键又含有极性共价键的离子晶体是NaOH、(NH4)2S.
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,铵根离子和酸根离子之间也存在离子键,非金属元素之间易形成共价键,正负电荷重心重合的分子为非极性分子,根据构成微粒确定晶体类型,
NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键,属于离子晶体;
Na2S中钠离子和硫离子之间存在离子键,属于离子晶体;
(NH4)2S中存在配位键和离子键,属于离子晶体;
Na2O2中钠离子和过氧根离子之间存在离子键、O原子之间存在非极性共价键,属于离子晶体;
C2H2中C原子和H原子之间存在极性键、C原子之间存在非极性键,属于分子晶体;
SiC中Si原子和C原子之间存在极性键,属于原子晶体,以此解答该题.
解答 解:NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键,属于离子晶体;
Na2S中钠离子和硫离子之间存在离子键,属于离子晶体;
(NH4)2S中存在配位键和离子键,属于离子晶体;
Na2O2中钠离子和过氧根离子之间存在离子键、O原子之间存在非极性共价键,属于离子晶体;
C2H2中C原子和H原子之间存在极性键、C原子之间存在非极性键,属于分子晶体;
SiC中Si原子和C原子之间存在极性键,属于原子晶体,
(1)其中只含有离子键的离子晶体是Na2S,故答案为:Na2S;
(2)含有极性共价键的原子晶体是SiC晶体,故答案为:SiC;
(3)既含有离子键又含有极性共价键和配位键的离子晶体是(NH4)2S,故答案为:(NH4)2S;
(4)既含有离子键又含有非极性共价键的离子晶体是Na2O2,故答案为:Na2O2;
(5)含有非极性共价键和π键的分子晶体是C2H2,故答案为:C2H2;
(6)既含有离子键又含有极性共价键的离子晶体是 NaOH、(NH4)2S,故答案为:NaOH、(NH4)2S.
点评 本题考查化学键类型、晶体类型、分子极性与非极性的判断,属于对基本概念的考查,题目难度不大,注意非极性分子的结构对称,正负电荷中心重合来,晶体类型的判断依据成键微粒.

(1)在甲、乙两个烧杯中,分别装入 40mL 浓度均为 2mol•L-1的稀硫酸和稀硝酸,并向其中各加入 4g 束状铜丝,观察现象,试完成下列实验报告:
| 实验示意图 | 实验现象 | 解释 |
甲: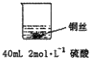 | 无明显现象 | 稀硫酸只能表现酸的氧化性,而铜排在金属活动顺序表氢之后,不能将氢置换出来. |
乙: | 铜丝逐渐溶解,铜丝表面有气泡产生,溶液颜色变蓝 | 稀硝酸是氧化性的酸,能与铜发生反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O |
(3)若甲中硫酸溶液体积 V(V>40mL)可变,其余数据不变,则:
①当甲、乙烧杯混合充分反应后,溶液中只有一种溶质时,V=60mL
②能否通过硫酸溶液体积的改变,使铜丝在甲、乙烧杯混合充分反应后完全溶解?试写出推理过程否.
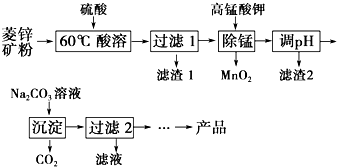 以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:
以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ |
| 开始沉淀时pH | 5.8 | 1.1 | 5.9 |
| 完全沉淀时pH | 8.8 | 3.2 | 8.0 |
(2)用KMnO4溶液除去Mn2+的离子方程式为2MnO4-+3Mn2++2H2O═5MnO2↓+4H+.
(3)滤渣2主要成分的化学式是Fe(OH)3.
(4)过滤2所得滤液中含有的主要阳离子是Na+、K+.
(5)生成的产品需经充分洗涤,检验产品完全洗净的方法是取最后一次洗涤液,加盐酸酸化的氯化钡溶液,若无沉淀,则已洗净.
(6)Zn2+完全沉淀时溶液中c(Zn2+)=10-5mol•L-1,则该温度下Ksp[Zn(OH)2]的值为10-17.
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| B. | 向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ | |
| C. | 向NaHCO3溶液中加过量Ca(OH)2溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 向BaCO3固体中加入过量的稀H2SO4:BaCO3+2H+═Ba2++CO2↑+H2O |
| A. | 原子半径:X>Y>Z | B. | 气态氢化物的稳定性HX>H2Y>ZH3 | ||
| C. | 电负性:X>Y>Z | D. | 非金属性:X>Y>Z |
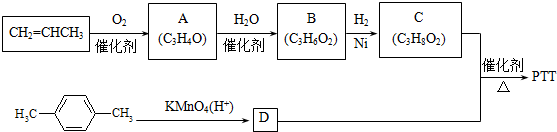
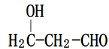 .
.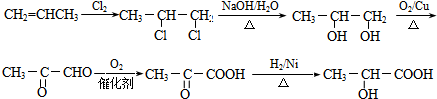 .
.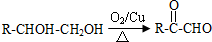

 ; F
; F  ;
;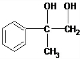 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;
+2H2O;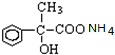 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.