题目内容
【题目】已知:pOH=-lgc(OH-)。常温下,某弱酸的钠盐(Na2XO3)溶液中微粒浓度的变化关系如下图所示。下列说法正确的是

A. 实线M表示pOH与lg 的变化关系
的变化关系
B. 在NaHXO3溶液中:![]() >1
>1
C. 向Na2XO3溶液中滴加稀盐酸至溶液显中性时:c(Na+)+2c(H+)=c(HXO3-)+2c(XO32-)+2c(OH-)
D. Na2XO3溶液加水稀释,![]() 先增大后不变
先增大后不变
【答案】B
【解析】Na2XO3为强碱弱酸盐,水解显碱性,分2步水解:XO32-+H2O== HXO3-+ OH- HXO3-+ H2O==H2XO3+OH-;水解的第一步程度较大,因此c(HXO3-) /c(XO32-)比值较大,当c(HXO3-) /c(XO32-)=10-4时,溶液的碱性最强,pOH=0;第二步水解受到第一步抑制,水解程度较小,c(H2XO3)/c(HXO3-)比值较小,当c(H2XO3)/ c(HXO3-)=10—9时,溶液的碱性最强,溶液 pOH=0;所以实线M表示pOH与![]() 的变化关系,A错误;
的变化关系,A错误;![]() =c(OH-)×c(HXO3-)×c(H2XO3)/ c(H+)×c(XO32-)×c(HXO3-)=Kh/Ka1,根据图像当
=c(OH-)×c(HXO3-)×c(H2XO3)/ c(H+)×c(XO32-)×c(HXO3-)=Kh/Ka1,根据图像当![]() =0时,溶液的pOH=4;水解大于电离过程,溶液显碱性,所以Kh/Ka1>1,即:
=0时,溶液的pOH=4;水解大于电离过程,溶液显碱性,所以Kh/Ka1>1,即:![]() >1,B正确;向Na2XO3溶液中滴加稀盐酸至溶液显中性时,溶液中存在电荷守恒:c(Na+)+c(H+)=c(HXO3-)+2c(XO32-)+c(OH-),C错误;Na2XO3溶液加水稀释,水解程度增大,但是溶液中c(HXO3-)、c(OH-)均减小,温度不变,KW不变,因此c(H+)增大;Na2XO3溶液加水稀释,
>1,B正确;向Na2XO3溶液中滴加稀盐酸至溶液显中性时,溶液中存在电荷守恒:c(Na+)+c(H+)=c(HXO3-)+2c(XO32-)+c(OH-),C错误;Na2XO3溶液加水稀释,水解程度增大,但是溶液中c(HXO3-)、c(OH-)均减小,温度不变,KW不变,因此c(H+)增大;Na2XO3溶液加水稀释,![]() 一直增大;D错误;正确选项B。
一直增大;D错误;正确选项B。

 阅读快车系列答案
阅读快车系列答案【题目】“钢是虎,钒是翼,钢含钒犹如虎添翼”,金属钒被誉为“合金的维生素”。从废钒(主要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如下图所示: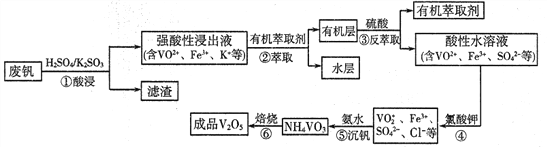
已知:步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)![]() RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)。
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)。
回答下列问题:
(1)步骤①酸浸过程中发生氧化还原反应的化学方程式为______________。
(2)萃取时应加入适量碱的作用是___________________。
(3)步骤④中反应的离子方程式为___________________。
(4)步骤⑤25°C时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
通过表中数据分析,在实际生产中,⑤中加入氨水,调节溶液的最佳pH范围为______;
若加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<_____mol/L(按25℃计算,25℃时Ksp[Fe(OH)3]=2.6×10-39)。
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为VO+,则V2O5与氢碘酸反应的离子方程式为_________________。
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=_______mol/L(萃取率=![]() )
)