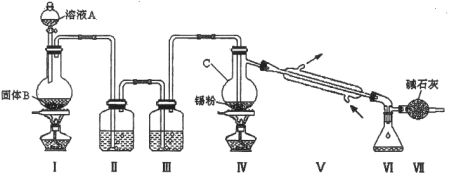
题目内容
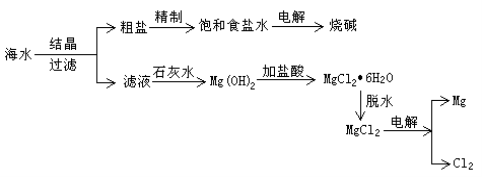
【题目】从海水中可提取各种化工产品,下图是工业上对海水的一种综合利用的流程图:
⑴ 在实验室对海水进行过滤,所需要玻璃仪器为烧杯、漏斗和 ,补填的玻璃仪器在过滤时,起到了 的作用。
⑵ 若粗盐中仅含有Ca2+、Mg2+两种杂质离子。精制提纯时,备用的除杂试剂有:(A.盐酸 B.Na2CO3溶液 C.NaOH溶液)请你正确排列加入的顺序:( )、( )、( )(填编号)
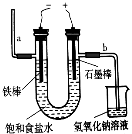
⑶ 用如图电解食盐水,石墨电极上产生的气体为 ;在铁棒周围的溶液里滴加酚酞,溶液变 色。
【答案】
(1)玻璃棒;引流;
(2)B、C、A或C、B、A;
(3)氯气;红色
【解析】
试题分析:煅烧贝壳发生的反应为CaCO3![]() CO2↑+CaO,氧化钙和水反应制得石灰乳,反应方程式为:CaO+H2O=Ca(OH)2,镁离子和石灰乳反应生成氢氧化镁沉淀,离子方程式为:Mg2++2OH-=Mg(OH)2↓,氢氧化镁和稀盐酸反应生成氯化镁,反应方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,电解熔融氯化镁制得Mg,反应方程式为:MgCl2(熔融)
CO2↑+CaO,氧化钙和水反应制得石灰乳,反应方程式为:CaO+H2O=Ca(OH)2,镁离子和石灰乳反应生成氢氧化镁沉淀,离子方程式为:Mg2++2OH-=Mg(OH)2↓,氢氧化镁和稀盐酸反应生成氯化镁,反应方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,电解熔融氯化镁制得Mg,反应方程式为:MgCl2(熔融)![]() Mg+Cl2↑,氢气在氯气中燃烧得到氯化氢,反应方程式为H2+Cl2=2HCl。
Mg+Cl2↑,氢气在氯气中燃烧得到氯化氢,反应方程式为H2+Cl2=2HCl。
(1)实验室对海水进行过滤,所需要玻璃仪器为烧杯、漏斗和玻璃棒,玻璃棒起到引流的作用;故答案为:玻璃棒;引流;
⑵ 根据提供的试剂,可以选用Na2CO3溶液除去粗盐中仅含有Ca2+、再用NaOH溶液除去Mg2+,最后加入盐酸调节溶液的pH,因此加入的顺序为B、C、A或C、B、A,故答案为:B、C、A或C、B、A;
⑶ 根据图示,石墨电极为阳极,发生氧化反应,溶液中的氯离子放电生成氯气,铁为阴极,溶液中的氢离子放电生成氢气,铁棒周围的溶液的碱性增强,滴加酚酞,溶液变红色,故答案为:氯气;红色。

【题目】已知:2NaAlO 2 + 3H2O +CO2→2Al(OH)3↓+Na2CO3。向含2molNaOH、 1 mol Ba(OH)2、2 molNaAlO 2的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量关系正确的是
选项 | A | B | C | D |
n(CO2)mol | 2 | 3 | 4 | 6 |
n(沉淀) mol | 2 | 2 | 3 | 3 |