题目内容
能正确解释下列反应原理的离子方程式是( )
分析:A、小苏打是碳酸氢钠,不是碳酸钠;
B、根据铝离子与氢氧根离子物质的量满足1:3;
C、醋酸是弱电解质,必须写出化学分子式,不能拆开;
D、根据电荷守恒判断,方程式两边电荷不相等.
B、根据铝离子与氢氧根离子物质的量满足1:3;
C、醋酸是弱电解质,必须写出化学分子式,不能拆开;
D、根据电荷守恒判断,方程式两边电荷不相等.
解答:解:A、小苏打是碳酸氢钠,反应的离子方程式为:HCO3-+H+═CO2↑+H2O,故A错误;
B、根据Al3+刚好沉淀完全,必须满足铝离子与氢氧根离子物质的量比为1:3,反应的离子方程式为:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓,故B正确;
C、醋酸是弱电解质,离子方程式中写成分子式,反应的离子方程式为:CaCO3+2CH3COOH═Ca2++CO2↑+H2O+2CH3COO-,故C错误;
D、方程式两边电荷不相等,正确的离子方程式为:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故D错误;
故选B.
B、根据Al3+刚好沉淀完全,必须满足铝离子与氢氧根离子物质的量比为1:3,反应的离子方程式为:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓,故B正确;
C、醋酸是弱电解质,离子方程式中写成分子式,反应的离子方程式为:CaCO3+2CH3COOH═Ca2++CO2↑+H2O+2CH3COO-,故C错误;
D、方程式两边电荷不相等,正确的离子方程式为:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故D错误;
故选B.
点评:本题考查了离子方程式的书写,注意判断离子方程式正误时,电荷守恒和电子守恒的应用,本题难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一.对下列事实解释正确的是( )
|
下列说法正确的是( )
| A、将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁 | ||
| B、饱和FeCl3溶液在20℃时呈现棕黄色,100℃呈现红褐色,不能用平衡移动原理来解释 | ||
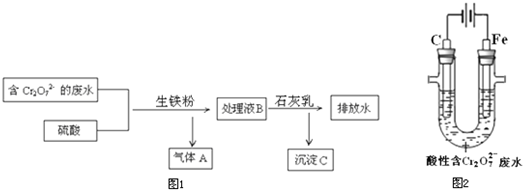
C、在
| ||
| D、在原电池装置中,电子从负极流出,沿导线流入正极,经溶液或盐桥回到负极 |
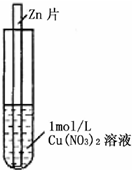 (2011?上饶二模)如图,将一锌片放入1mol?L-1蓝色Cu(NO3)2溶液中,观察到下列实验现象:①反应初期锌片上有大量气泡冒出,同时液面的上一层Cu(NO3)2溶液开始呈现绿色,并且逐渐向液面下的深处扩散,试管底部有红色固体出现.②与锌片接触的溶液温度明显升高,反应越来越剧烈,并在红色固体上方开始出现一层蓝色沉淀,并逐渐增多.③反应后期溶液逐渐变为无色,试管底部又有部分白色沉淀物.
(2011?上饶二模)如图,将一锌片放入1mol?L-1蓝色Cu(NO3)2溶液中,观察到下列实验现象:①反应初期锌片上有大量气泡冒出,同时液面的上一层Cu(NO3)2溶液开始呈现绿色,并且逐渐向液面下的深处扩散,试管底部有红色固体出现.②与锌片接触的溶液温度明显升高,反应越来越剧烈,并在红色固体上方开始出现一层蓝色沉淀,并逐渐增多.③反应后期溶液逐渐变为无色,试管底部又有部分白色沉淀物.