��Ŀ����
����Ŀ�������ܼ��еĵ���ʵ�������е�H+ת�Ƹ��ܼ����ӣ���HCl+H2O=H3O++Cl�� �� ��֪H2SO4��HNO3�ڱ������еĵ���ƽ�ⳣ��Ka1��H2SO4��=6.3��10��9 �� Ka��HNO3��=4.2��10��10 �� ����˵����ȷ���ǣ� ��
A.��������H2SO4�ĵ��뷽��ʽ��H2SO4+2CH3COOH=SO42��+2CH3COOH2+
B.H2SO4�ı�������Һ�У�c��CH3COOH2+��=c��HSO4����+2c��SO42����+c��CH3COO����
C.Ũ�Ⱦ�Ϊ0.1mol?L��1��H2SO4��HNO3�ı�������Һ��pH��H2SO4����pH��HNO3��
D.��HNO3�ı�������Һ�м�������ᣬ ![]() ��С
��С
���𰸡�B
��������A����������H2SO4�������ֵ��룬�ֲ����룬�Ե�һ������Ϊ�������������H2SO4�ĵ��뷽��ʽ��H2SO4+CH3COOHHSO4��+CH3COOH2+ �� ��A����
B��H2SO4�ı�������Һ�д��������غ㣺c��CH3COOH2+��=c��HSO4����+2c��SO42����+c��CH3COO��������B��ȷ��
C���ڱ������е���ĵ���ƽ�ⳣ��Խ�������������Ũ��Խ��pHԽС������ĵ��볣��������H2SO4��������Ũ�ȴ���pH��H2SO4����pH��HNO3������C����
D����HNO3�ı�������Һ�м�������ᣬ��Һ�����������c��NO3������С�����볣��Ϊ 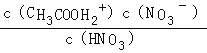 �dz���������
�dz��������� 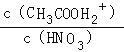 ����D����
����D����
��ѡB��
�����㾫����ͨ������������������ˮ��Һ�еĵ���ƽ�⣬���յ�������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ�������Խ����⣮

 ������ҵ����ν�����������ϵ�д�
������ҵ����ν�����������ϵ�д�


