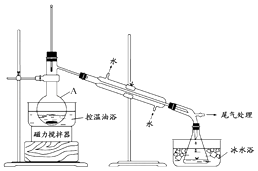
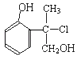
��Ŀ����
����Ŀ��������Ҫ�Ļ���ԭ�ϣ���;�㷺��
��1���ϳɰ��������ô��������ͭ����[Cu��NH3��2]+��CH3COO�����ɣ���Һ���ն��ϳɴ����ж�����CO���壮
�ٴ��������ͭ������Ԫ���У���һ������������ ��
�ڴ��������ͭ����Ԫ�صĵ��ʣ������ľ���������������ţ���
a�����Ӿ��� b�����Ӿ��� c��ԭ�Ӿ��� d����������
�۵�4�����У���̬ԭ�����̬Cuԭ��δ�ɶԵ�����Ŀ��ͬ��Ԫ�����֣�����Cu����
��ͭ����Ϊ�����������壬�侧���߳�a nm����ʽ��ʾͭ���ʵ��ܶ� gcm��3 ��
��2��BF3������NH3������������һ�ְ�ɫ���壺BF3+NH3=F3B��NH3 ��
�پ���F3B��NH3�У�Bԭ�ӵ��ӻ��������Ϊ ��
��д��������BF3������ͬ�ռ乹�͵��������� ��
��3��NH3�����ںϳ����ء�����淋ȵ��ʣ�ij���ʳ���������������м��һ�����ΪN4H4��SO4��2�����ʣ���������ˮ��Һ����SO42����N4H44+�����������幹�͵����Ӵ��ڣ�N4H44+��������һ�����ư���N4���ӣ�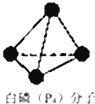
���������˵���У���ȷ����������ţ���
a��N4��N2��ͬ���칹��
b��1mol N4�ֽ�����N2 �� �γ���4mol �м�
c�����ķе��N4�ߣ�����ΪP��P�����ܱ�N��N����
d�����Ļ�ѧ���ʱ�N2���ã�˵��P�ķǽ����Ա�Nǿ
�ڻ���N4H44+�Ľṹ���������е���λ���� ��
���𰸡�
��1������b��c��d��4��![]()
��2��sp3��CO32����NO3��
��3��b��
����������1���ٷǽ�����Խǿ����һ������Խ�������������Ų�����ȫ�������״̬ʱ���ȶ�������ʧ���ӣ���һ�����ܽϴ��������ͭ������Ԫ����Cu��O��C��H��N������Nԭ�ӵ�������Ų�Ϊ����״̬����һ�����ܽϴ����Ե�һ������������N�����Դ��ǣ������ڴ��������ͭ����Ԫ����ɵĵ��ʣ���ͭ���ڽ������塢���ʯ����ԭ�Ӿ��塢�������������ڷ��Ӿ��壻���Դ��ǣ�b��c��d����Cu����Χ�����Ų�Ϊ3d104s1 �� ֻ��1��δ�ɶԵ��ӣ���4����Ԫ���У���̬ԭ�Ӻ���һ��δ�ɶԵ��ӵ�Ԫ���У�K��Sc��GaBr������4��Ԫ�أ����Դ��ǣ�4���ܸþ�����ͭԭ�Ӹ���=8�� ![]() +6��
+6�� ![]() =4�������߳�a=a nm=a��10��7cm���������=��a��10��7cm��3 �� �ܶȦ�=
=4�������߳�a=a nm=a��10��7cm���������=��a��10��7cm��3 �� �ܶȦ�= ![]() =
= 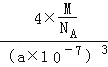 =
= ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����2���پ���F3B��NH3�У�Bԭ�ӵļ۲���Ӷ���Ϊ4�����ӻ�����Ϊsp3�ӻ��� ���Դ��ǣ�sp3����BF3��B�ļ۲���Ӷ���Ϊ3+
����2���پ���F3B��NH3�У�Bԭ�ӵļ۲���Ӷ���Ϊ4�����ӻ�����Ϊsp3�ӻ��� ���Դ��ǣ�sp3����BF3��B�ļ۲���Ӷ���Ϊ3+ ![]() =3��û�йµ��Ӷԣ����ӵĿռ乹��Ϊ�������Σ�CO32����̼ԭ�Ӽ۲���ӶԸ���=3+
=3��û�йµ��Ӷԣ����ӵĿռ乹��Ϊ�������Σ�CO32����̼ԭ�Ӽ۲���ӶԸ���=3+ ![]() ��4+2��3��2��=3���Ҳ����µ��Ӷԣ�����Cԭ�Ӳ���sp2�ӻ����ռ乹��Ϊƽ�������Σ�NO3�� ��Nԭ���γ�3���Ҽ����¶Ե�����=
��4+2��3��2��=3���Ҳ����µ��Ӷԣ�����Cԭ�Ӳ���sp2�ӻ����ռ乹��Ϊƽ�������Σ�NO3�� ��Nԭ���γ�3���Ҽ����¶Ե�����= ![]() ������ԭ��Ϊsp2�ӻ������幹��Ϊƽ�������Σ����Դ��ǣ�CO32����NO3������3����a������ʽ��ͬ�ṹ��ͬ�Ļ����ﻥ��ͬ���칹�壬N4��N2����NԪ�صĵ��ʣ�����ͬ�������壬��a����
������ԭ��Ϊsp2�ӻ������幹��Ϊƽ�������Σ����Դ��ǣ�CO32����NO3������3����a������ʽ��ͬ�ṹ��ͬ�Ļ����ﻥ��ͬ���칹�壬N4��N2����NԪ�صĵ��ʣ�����ͬ�������壬��a����
b��һ��N2�к���2�� �м���1mol N4 �ֽ�����2molN2 �� �γ���4mol �м�����b��ȷ��
c���ṹ���Ƶķ��Ӿ��壬��Է�����Խ���۷е�Խ�ߣ�������Է�������N4��������أ���c����d��ͬ������ϵ��£��ǽ����Լ�������P�ķǽ����Ա�N�������Ļ�ѧ���ʱ�N2���ã��빲�ۼ��ȶ����йأ���d����
���Դ��ǣ�b��
��N4H44+��ÿ��Nԭ��������3��Nԭ���γɹ��ۼ���ͬʱ��1���������γ���λ������N4H44+�ĽṹͼΪ 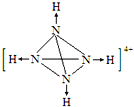 �����Դ��ǣ�
�����Դ��ǣ�  ��
��

 ϰ�⾫ѡϵ�д�
ϰ�⾫ѡϵ�д�