题目内容
将23g Na放在足量的Cl2中燃烧将燃烧后的产物通入水中得到100mL氯化钠溶液,计算:
(1)Na的物质的量
(2)氯化钠的物质的量浓度.
(1)Na的物质的量
(2)氯化钠的物质的量浓度.
考点:物质的量的相关计算,化学方程式的有关计算
专题:计算题
分析:(1)钠的摩尔质量为23g/mol,根据n=
计算出金属钠的物质的量;
(2)根据钠元素守恒得到NaCl的物质的量,再根据c=
计算出氯化钠的物质的量浓度.
| m |
| M |
(2)根据钠元素守恒得到NaCl的物质的量,再根据c=
| n |
| V |
解答:
解:(1)23g金属钠的物质的量为:n(Na)=
=1mol,
答:钠的物质的量为1mol;
(2)由钠元素守恒可知,n(NaCl)=n(Na)=1mol,
则溶液中氯化钠的物质的量浓度为:c(NaCl)=
=
=10mol/L,
答:氯化钠的物质的量浓度为:10mol/L.
| 23g |
| 23g/mol |
答:钠的物质的量为1mol;
(2)由钠元素守恒可知,n(NaCl)=n(Na)=1mol,
则溶液中氯化钠的物质的量浓度为:c(NaCl)=
| n(NaCl) |
| V |
| 1mol |
| 0.1L |
答:氯化钠的物质的量浓度为:10mol/L.
点评:本题考查了有关物质的量的计算、物质的量浓度的计算,题目难度不大,注意掌握物质的量与摩尔质量、物质的量浓度等物理量之间的关系,明确物质的量浓度的概念及计算方法.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
(双选)下列变化中属于原电池反应的是( )
| A、白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化 |
| B、在空气中金属铝表面迅速被氧化形成保护膜 |
| C、红热的铁丝与水接触表面形成蓝色保护层 |
| D、在铁与稀H2SO4反应时,加几滴CuSO4溶液,可加快H2的产生 |
已知:2NO2(g) N2O4(g)△H=-57.20kJ?mol-1.一定温度下,在密闭容器中反应2NO2(g)
N2O4(g)△H=-57.20kJ?mol-1.一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是( )
N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是( )
 N2O4(g)△H=-57.20kJ?mol-1.一定温度下,在密闭容器中反应2NO2(g)
N2O4(g)△H=-57.20kJ?mol-1.一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是( )
N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是( )| A、减小NO2的浓度 |
| B、降低温度 |
| C、增加压强 |
| D、升高温度 |
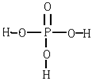 磷酸的结构式如图所示,三分子磷酸可脱去两分子水生成三聚磷酸.含磷洗衣粉中含有三聚磷酸,则该钠盐的化学式及1mol此钠盐中P-O单键的物质的量分别是( )
磷酸的结构式如图所示,三分子磷酸可脱去两分子水生成三聚磷酸.含磷洗衣粉中含有三聚磷酸,则该钠盐的化学式及1mol此钠盐中P-O单键的物质的量分别是( )| A、Na5P3O10 7mol |
| B、Na3H2P3O10 8mol |
| C、Na5P3O10 9mol |
| D、Na2H3P3O10 12mol |
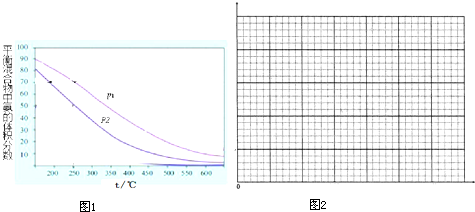
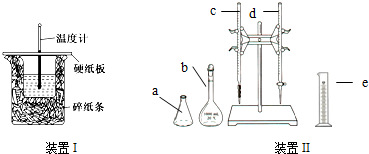
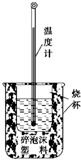 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题: