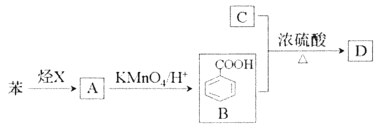
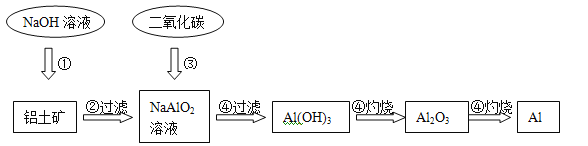
题目内容
【题目】工业合成氨反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH =-92.0kJ·mol-1,恒容时,体系中各物质浓度随时间变化曲线如图所示,下列说法正确的是
2NH3(g) ΔH =-92.0kJ·mol-1,恒容时,体系中各物质浓度随时间变化曲线如图所示,下列说法正确的是
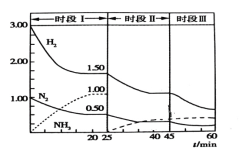
A.25min时采取的措施是降低温度或增大压强
B.将0.5 mol氮气、1.5 mol氢气置于1 L密闭容器中发生反应,放出的热量为46 kJ
C.Ⅰ、Ⅱ、Ⅲ 三个时间段平衡时平衡常数:KⅢ > KⅠ = KⅡ
D.为了增大合成氨的产率可以通过使用催化剂、原料的循环使用来实现
【答案】C
【解析】
A.25min时N2和H2浓度降低,NH3浓度突然降低,采取的措施是将NH3从体系中分离,A错误;
B.该反应为可逆反应。物质不能100%转化,0.5mol氮气、1.5mol氢气置于1L密闭容器中发生反应,放出的热量小于46kJ,B错误;
C.25min时为将NH3从体系中分离,45min时,组分浓度没有改变,之后N2和H2浓度降低,NH3浓度突然增大,说明反应向正反应方向移动,改变的条件是降温,平衡常数与温度相关,Ⅰ、Ⅱ温度相同,则KⅠ=KⅡ;该反应为放热反应,温度降低K增大,Ⅲ的平衡常数大,故KⅢ>KⅠ=KⅡ,C正确;
D、催化剂不影响化学平衡,不改变合成氨的产率,D错误;
答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目